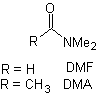Reaktionen von Enolen und Enolaten
Aldolreaktionen und die sogenannten Kondensationsreaktionen von Carbonylverbindungen und anderen dieser Art, die Enol- und Enolatstrukturen bilden können, nehmen an einer großen Gruppe wichtiger Reaktionen teil, die es uns ermöglichen, die Existenz einer immensen Anzahl von Molekülen zu verstehen, die aus der Wechselwirkung von Enolen oder Enolaten mit einer Reihe von elektrophilen Gruppen resultieren.
Die Untersuchung dieser Art von Reaktion hat es ermöglicht, die Existenz von zwei Reaktionsmechanismen, durch die sie auftreten, zu verifizieren und zu etablieren, wie nachstehend erläutert:
ZU)
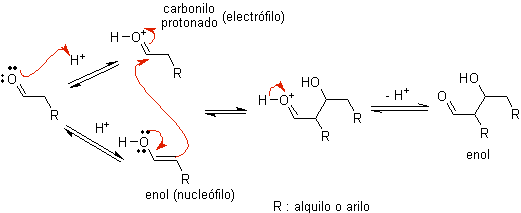
Wenn Säure als Katalysator verwendet wird , wird die Carbonylverbindung zunächst protoniert und dann zu ihrer Enolform tautomerisiert , die ein Nucleophil am Alpha-Kohlenstoff der Carbonylgruppe ist. Das gleiche saure Medium reicht aus, um die Carbonylgruppe eines anderen Moleküls zu aktivieren, wodurch es hoch elektrophil wird, was optimale Bedingungen zur Herstellung einer ungesättigten Carbonylverbindung schafft.
Die Reaktion läuft normalerweise bis zur Dehydratisierung des gebildeten Enols ab, katalysiert durch die gleiche Säure der Reaktion.
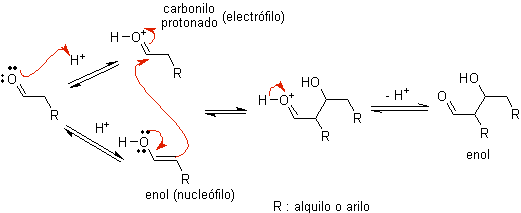
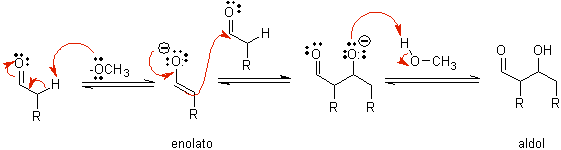
B) Wenn der Katalysator eine Base ist, wie beispielsweise ein Alkoxid, verläuft die Reaktion vom Aldoltyp über den nukleophilen Angriff des resonanzstabilisierten Enolats auf die Carbonylgruppe eines anderen Moleküls.
Durch basisch katalysierte Dehydratisierung des Aldols entsteht das dehydratisierte Endprodukt.
Wie im vorherigen Fall ermöglicht die basenkatalysierte Dehydratisierung (manchmal als Einzelschritt geschrieben) die Kontrolle der Reaktion und die Herstellung eines dehydratisierten Endprodukts. In einigen Fällen ist die Bildung von Enolaten irreversibel.
wie es aussieht in manchen Fällen ist nur eine katalytische Menge an Base erforderlich, das üblichste Verfahren ist die Verwendung einer estequiométrica Menge einer starken Base wie LDA oder NaHMDS . In diesem Fall ist die Enolatbildung irreversibel und das Aldolprodukt wird erst gebildet, wenn das Metallalkoholat des Aldolprodukts in einem späteren Schritt protoniert wird.
Synthetische Äquivalente verschiedener Enole und Enolate
enolieren |
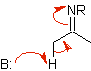
Azaenolat |
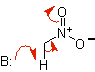
Nitroalkanenolat |
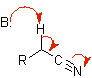
Nitrilenolat |
| |||
Ester, Amid |
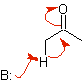
Imin |
Nitroalkan |
Nitril |
enol |
Enolether |
Enolester |
Silylenolether |
Enamin |
Alkylierung von Enolen und Enolaten:
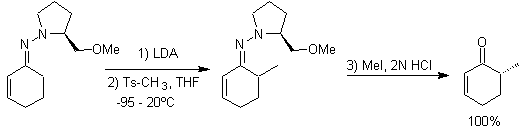
Die Alkylierung von Enolaten entspricht meist einer nukleophilen Substitutionsreaktion mit Alkylhalogeniden und Epoxiden. Dabei lassen sich primäre Alkyl- und Benzylhalogenide gut alkylieren, sekundäre Alkylhalogenide nur teilweise und tertiäre Alkylhalogenide reagieren grundsätzlich nicht mit Enolaten, da die Reaktion über einen nukleophilen Substitutionsmechanismus abläuft
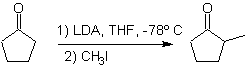
Andererseits wird die Geschwindigkeit der Alkylierung durch die Polarität der als Reaktionsmedium verwendeten Lösungsmittel erhöht.
|
|
| ||
|
|
| ||
FACKEL | NaHMDS | DIPEA | ||
Cy2BCl | Bu 2 BOTF |
Alkylierung von Silylenolethern , katalysiert durch Lewis-Säuren. Alkylierung Y N 1


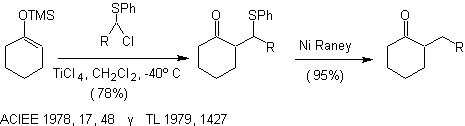
Alkylierung von Enolaten von Verbindungen a , b ungesättigte Carbonyle:
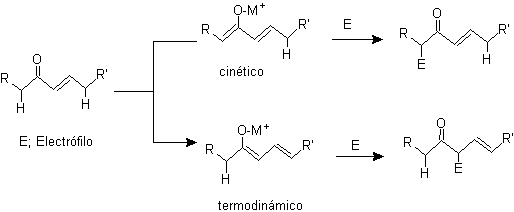
¨
g -Alkylierung ungesättigter Ketone in a , b
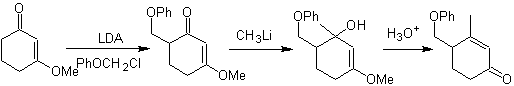
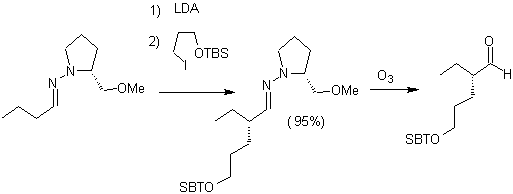
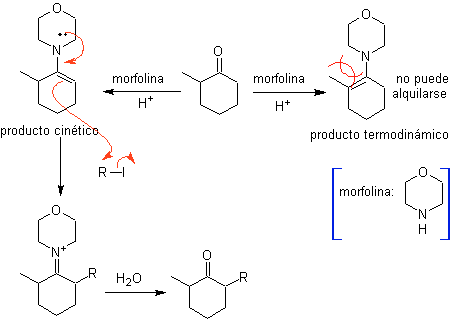
Alkylierung von Enaminen .
Die Monolaquilation und die Bildung des kinetischen Produkts werden unter Ausnutzung des sterischen Effekts kontrolliert, wofür ein voluminöses sekundäres Amin wie Morpholin verwendet werden muss.
Andererseits erzeugen chirale Enamine bei der Alkylierung auch chirale alpha-substituierte Ketone
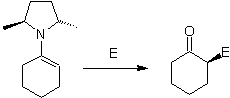
Alkylimine: Imine, die mit Ketonen isoelektronisch sind, können in Enamine umgewandelt werden, die dann alkyliert oder mit einem Reagenz umgesetzt werden können. elektrophil.
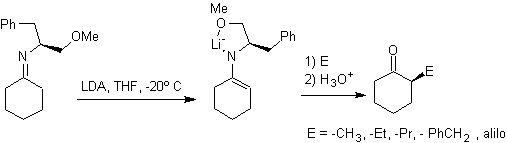
¨
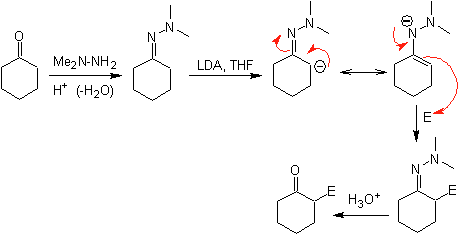
Hydrazon-Anionen sind viel reaktiver als die entsprechenden Aldehyd- oder Keton-Enolate.
¨
Es gibt einen Nachteil, da es bei der abschließenden Hydrolyse zu Schwierigkeiten kommen kann.
¨
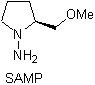
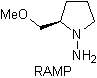
Chirale Hydrazone werden für die asymmetrische Alkylierung verwendet (RAMP/SAMP-Hydrazone werden in der asymmetrischen Synthese verwendet)
|
|