organocatalyse asymétrique
Introduction
Malgré l'importance de la chiralité, l'obtention de molécules chirales sous forme énantiomériquement pure est restée extrêmement limitée jusqu'à très récemment. Depuis la fin du XIXe siècle, la synthèse de molécules chirales de manière stéréosélective est un défi synthétique de grande ampleur auquel les chimistes organiques ont répondu avec beaucoup d'ingéniosité et de brio.
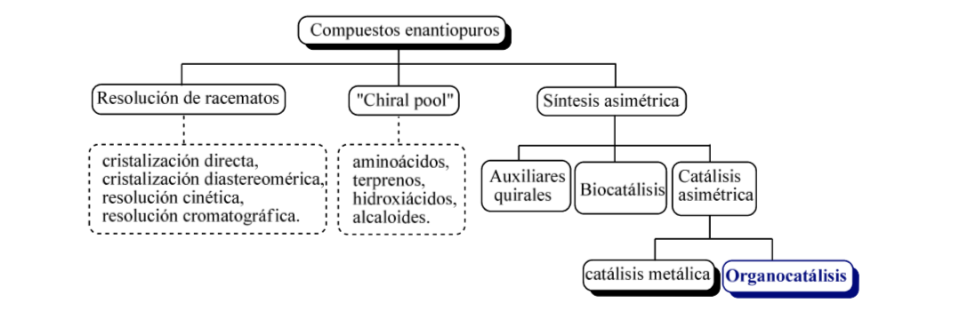
Dans les grandes lignes, trois stratégies de base peuvent être envisagées pour obtenir des composés énantiomériquement purs, tels que
a) la résolution des racémates,
b) l'utilisation de molécules naturelles optiquement actives
c) synthèse asymétrique.
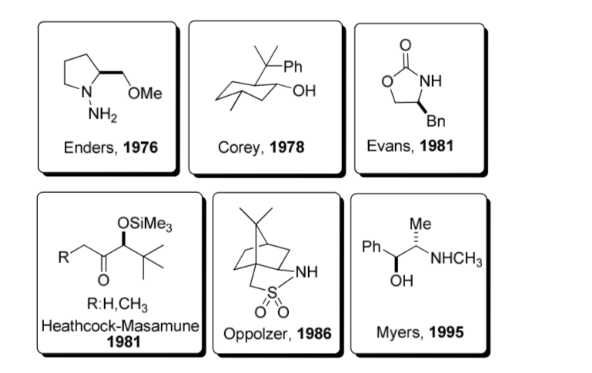
Utilisation d'auxiliaires chiraux :
Un auxiliaire chiral est un composé ou une unité chimique qui est temporairement incorporé dans une synthèse organique afin qu'elle puisse être réalisée de manière asymétrique, avec formation sélective d'un des deux énantiomères.
Cette stratégie a acquis une popularité considérable dans les années 1980 et aujourd'hui, une large gamme d'auxiliaires est connue pour un grand nombre de réactions. Certains des auxiliaires les plus représentatifs sont présentés dans la figure
Qu'est-ce que l'organocatalyse asymétrique ?
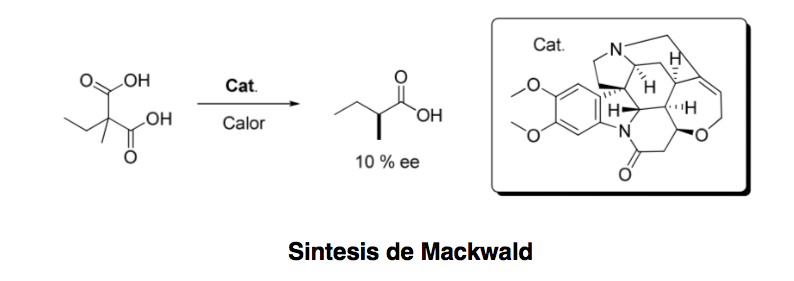
L'organocatalyse asymétrique ou catalyse asymétrique peut être définie comme "l'accélération de réactions chimiques avec une quantité sous-stoechiométrique d'un composé organique, qui ne contient aucun atome de métal à l'aide de molécules organiques de nature chirale." Bien que le premier exemple de transformation énantiosélective organocatalytique datant remontant à 1904, lorsque Mackwald procéda à la décarboxylation d'un dérivé acide en présence de brucine, ce n'est que depuis quelques années que ce domaine connaît un renouveau spectaculaire.
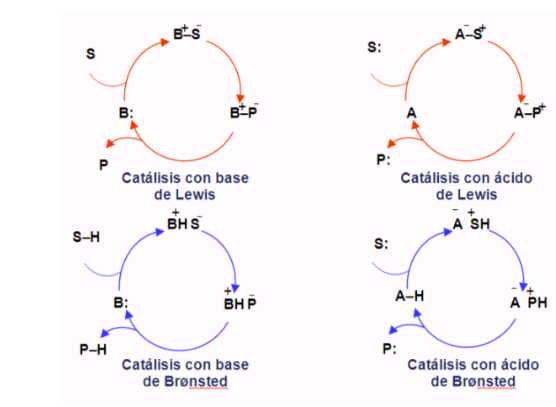
Cycles organocatalytiques
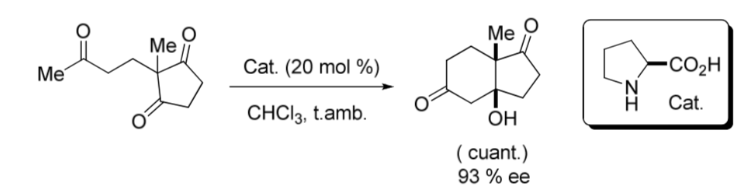
Une étape importante dans le domaine de l'organocatalyse asymétrique a été la réaction d'aldol intramoléculaire catalysée par la L -Proline publiée à la fin des années 1960 et au début des années 1970 par les groupes Hajos et Parrish ; et par un autre Ender, Wiechert et Sauer indépendamment comme le montre ce qui suit. image:
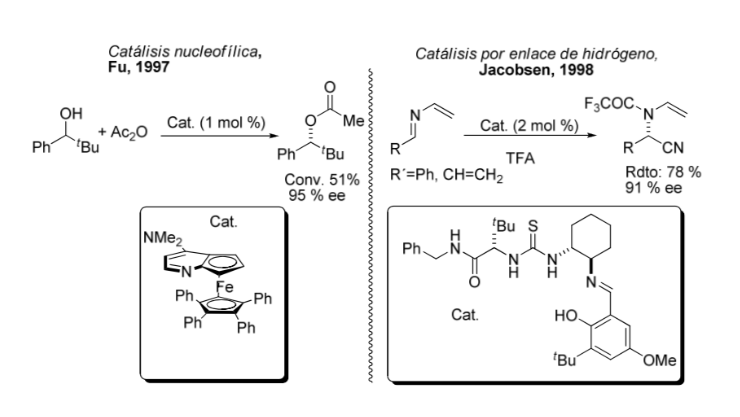
Comparaison entre catalyse organométallique et asymétrique :
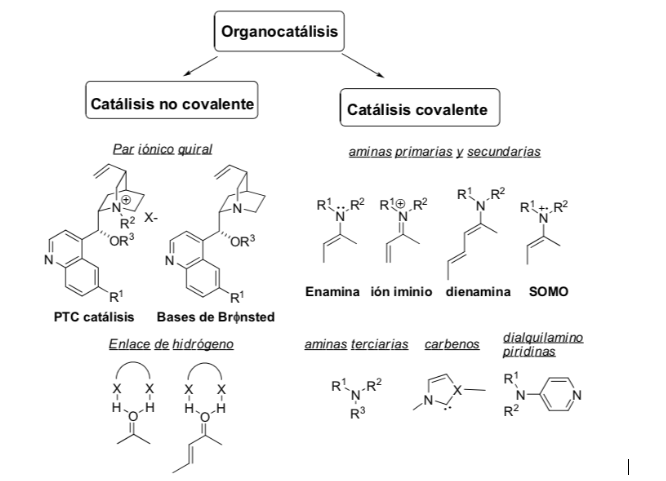
Méthode d'activation :
Sources pour élargir la recherche :
Berkessel, A. et Groeger, H. Organocatalyse asymétrique : des concepts biomimétiques aux applications en synthèse asymétrique » , Wiley-VCH : Weinheim, 2005.
Bui, T., Syed, S. et Barbas, CF, Additions hautement énantiosélectives et diastéréosélectives catalysées par la thiourée d'oxindoles aux nitrooléfines : application à la synthèse formelle de la (+)-physostigmine, J. Am. Chem. Soc . 131 , 8758-8759, 2009.
Hernández-Rodríguez, M. et Juaristi, E., Thiourées chirales structurellement simples en tant qu'agents solvatants chiraux dans l'énantiodiscrimination des acides carboxyliques, Tetrahedron 63 , 7673-7678, 2007.
Juaristi, E. Prix Nobel de Chimie 2001 : L'importance de la synthèse asymétrique, Educ . 13 , 6-7, 2002. .
Juaristi, E. Synthèse asymétrique d'acides aminés précieux, dans les contributions scientifiques et humanistes mexicaines au XXe siècle , Paredes, O. et Estrada, S., Eds., Fondo de Cultura Económica: México, 2008, p. 440-446.
Juaristi, E. Synthèse énantiosélective des acides aminés â, Wiley-VCH : New York, 1997.
Juaristi, E. et Soloshonok, VA (Eds.) Deuxième édition de la synthèse énantiosélective des acides aminés â -, Wiley : New York, 2005. Liu, Y., Melgar, R. et Juaristi, E. Enantioselective amination of
á-phényl á-cyanoacétate catalysé par des amines chirales incorporant l'auxiliaire á-phényléthyle, J. Org. Chem.72 , 1522-1525 , 2007.
MacMillan, DWC, L'avènement et le développement de l'organo-catalyse, Nature 455 , 304-308, 2008.
Marigo, M., Juhl, K. et Jorgensen, KA, Catalytique, hautement énantiosélective, amination directe de bêta-cétoesters, Angew. Chem., Int. Ed. 42 , 1367-1369, 2003.
Mukherjee, S.; Yang, JW; Hoffman, S.; List, B., Catalyse enamine asymétrique, Chem. Rev. 107 , 5471-5569, 2007.
Olivares-Romero, JL et Juaristi, E., Synthèse de deux nouvelles diamines chirales dérivées de ( S ) -Proline et leur évaluation en tant que précurseurs de diazaborolidines pour la réduction énantiosélective médiée par le borane catalytique des cétones prochirales, Tetrahedron 64, 9992-9998, 2008.
Seayad, J. et List, B., Organocatalyse asymétrique, Org. Biomol. Chem.3 , 719-724 , 2005.
Simon, L. et Goodman, JL, MechanismofBINOL−Phosphoric Acid-Catalysed Strecker Reaction of Benzyl Imines, J. Am. Chem. Soc. 131 , 4070-4077, 2009.
Tanaka, K., Mori, A. et Inoue, S., Le dipeptide cyclique cyclo[( S )-phénylalanyl-( S )-histidyle] comme catalyseur pour l'addition asymétrique de cyanure d'hydrogène aux aldéhydes, J. Org. Chem.55 , 181-185 , 1990.