асимметричный органокатализ
Введение
Несмотря на важность хиральности, получение хиральных молекул в энантиомерно чистой форме до недавнего времени оставалось крайне ограниченным. С конца 19-го века синтез хиральных молекул стереоселективным способом был синтетической проблемой большой важности, на которую химики-органики ответили с большой изобретательностью и блеском.
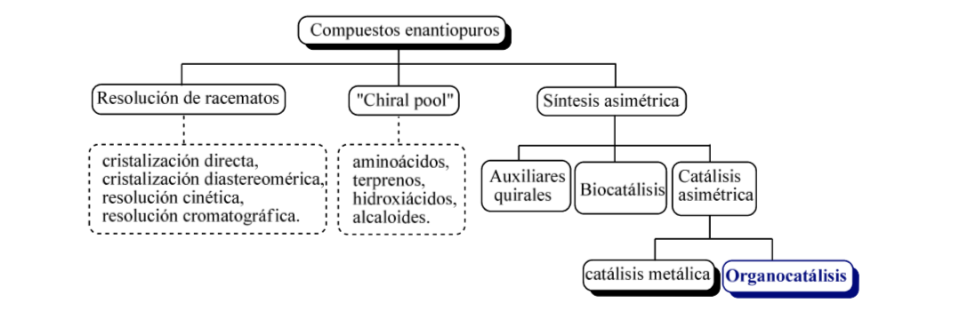
В общих чертах можно рассмотреть три основные стратегии получения энантиомерно чистых соединений, таких как
а) разрешение рацематов,
б) использование природных оптически активных молекул
в) асимметричный синтез.
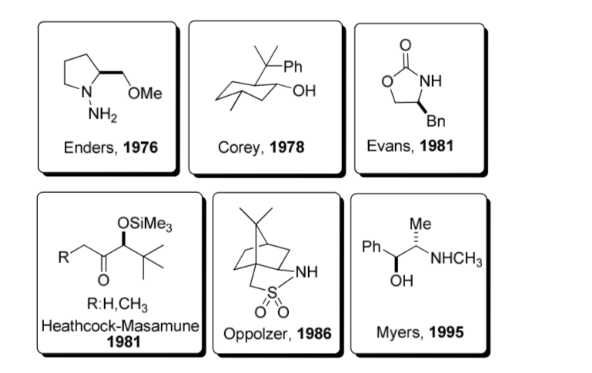
Использование хиральных вспомогательных веществ:
Хиральное вспомогательное вещество представляет собой химическое соединение или звено, которое временно включается в органический синтез, чтобы его можно было проводить асимметрично, с селективным образованием одного из двух энантиомеров.
Эта стратегия приобрела значительную популярность в 1980-х годах, и сегодня известен широкий спектр вспомогательных средств для большого количества реакций. Некоторые из наиболее репрезентативных вспомогательных средств показаны на рисунке.
Что такое асимметрический органокатализ?
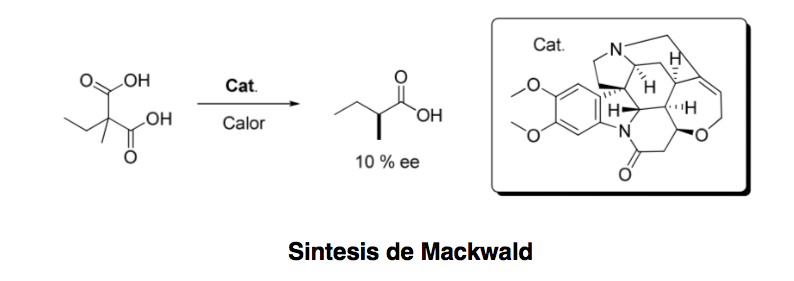
Асимметричный органокатализ или асимметричный катализ можно определить как «ускорение химических реакций с субстехиометрическим количеством органического соединения, не содержащего атомов металла, с использованием органических молекул хиральной природы». начиная с 1904 г., когда Маквальд осуществил декарбоксилирование производного кислоты в присутствии бруцина, только несколько лет назад эта область пережила впечатляющее возрождение.
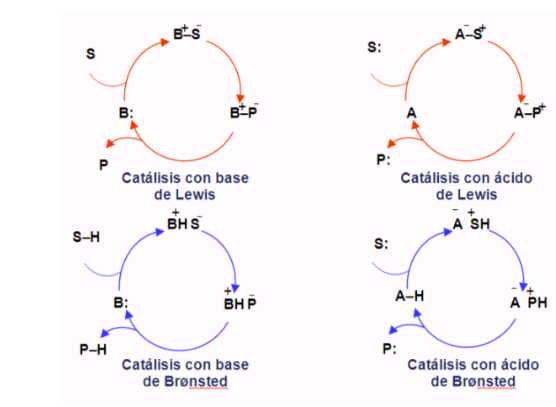
Органокаталитические циклы
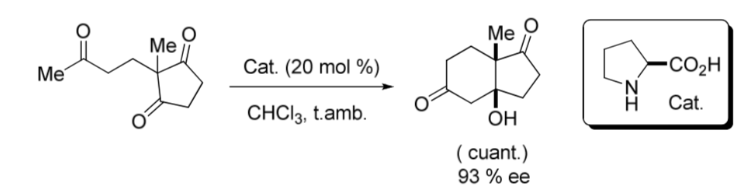
Важной вехой в области асимметричного органокатализа стала внутримолекулярная альдольная реакция, катализируемая L -пролином, опубликованная в конце 1960-х и начале 1970-х годов группами Хайоса и Пэрриша, а также Эндером, Вихертом и Зауэром независимо от того, как показано ниже. изображение:
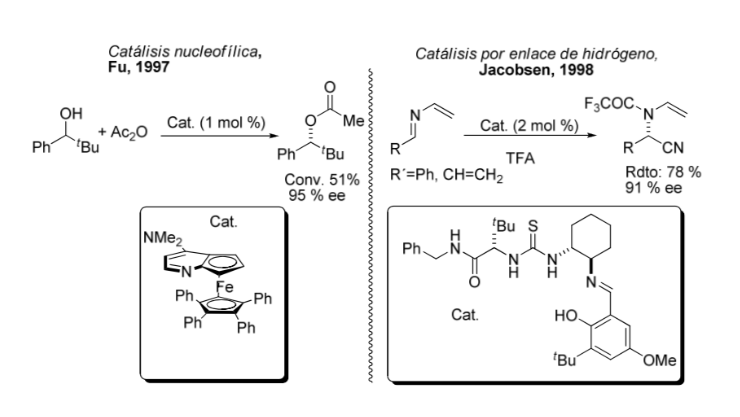
Сравнение металлоорганического и асимметричного катализа:
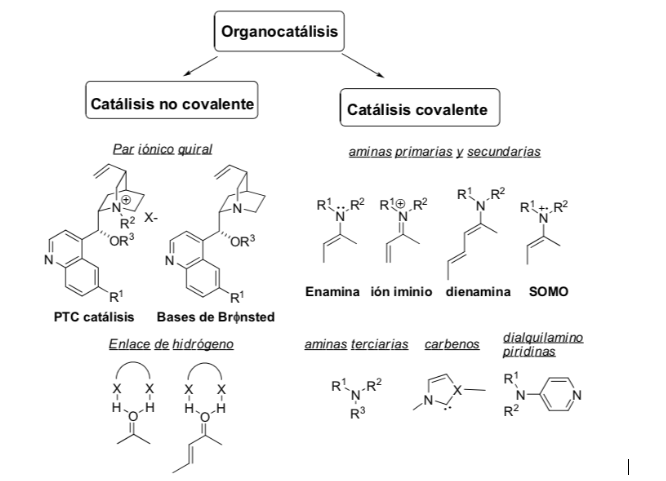
Способ активации:
Источники для расширения поиска:
Беркессель А. и Грогер Х. Асимметричный органокатализ: от биомиметических концепций до приложений в асимметричном синтезе» , Wiley-VCH: Weinheim, 2005.
Bui, T., Syed, S. и Barbas, CF, Катализируемые тиомочевиной высокоэнантио- и диастереоселективные добавки оксиндолов к нитроолефинам: применение к формальному синтезу (+)-физостигмина, J. Am. Chem. Soc . 131 , 8758-8759, 2009.
Эрнандес-Родригес, М. и Хуаристи, Э., Структурно простые хиральные тиомочевины в качестве хиральных сольватирующих агентов при энантиодискриминации карбоновых кислот, Tetrahedron 63 , 7673-7678, 2007.
Хуаристи, Э. Нобелевская премия по химии 2001 г.: важность асимметричного синтеза, Educ. quím . 13 , 6-7, 2002. .
Хуаристи, Э. Асимметричный синтез ценных аминокислот, в научных и гуманитарных вкладах Мексики в 20-м веке , Паредес, О. и Эстрада, С., ред., Fondo de Cultura Económica: México, 2008, p. 440-446.
Джуаристи, Э. Энантиоселективный синтез β -аминокислот , Wiley-VCH: Нью-Йорк, 1997.
Джуаристи Э. и Солошонок В.А. (ред.) Второе издание энантиоселективного синтеза β -аминокислот , Wiley: New York, 2005. Лю Ю., Мельгар Р. и Хуаристи Э. Энантиоселективное аминирование
β-фенил β-цианоацетат, катализируемый хиральными аминами, включающими β-фенилэтиловый вспомогательный компонент, J. Org. Chem., 72 , 1522-1525, 2007.
Макмиллан, DWC, Появление и развитие органического катализа, Nature 455 , 304-308, 2008.
Мариго М., Юл К. и Йоргенсен К.А. Каталитическое высокоэнантиоселективное прямое аминирование бета-кетоэфиров // Angew. Chem., Int. Ed. 42 , 1367-1369, 2003.
Мукерджи, С.; Ян, JW; Хоффман, С.; Лист Б., Асимметричный енаминовый катализ, Chem.Rev.107 , 5471-5569 , 2007.
Оливарес-Ромеро, Дж.Л. и Хуаристи, Э., Синтез двух новых хиральных диаминов, полученных из ( S )-пролина, и их оценка в качестве предшественников диазаборолидинов для каталитического боран-опосредованного энантиоселективного восстановления прохиральных кетонов, Tetrahedron 64, 9992-9998, 2008.
Seayad, J. и List, B., Асимметричный органокатализ, Org. биомол. Chem.3 , 719-724 , 2005.
Саймон Л. и Гудман Дж. Л., Механизм реакции Стрекера, катализируемой BINOL-фосфорной кислотой, бензилиминов, J. Am. Chem. Soc., 131 , 4070-4077, 2009.
Танака К., Мори А. и Иноуэ С. Циклический дипептид цикло[( S )-фенилаланил-( S )-гистидил] как катализатор асимметричного присоединения цианистого водорода к альдегидам, J. Org. Chem., 55 , 181-185, 1990.