organocatálise assimétrica
Introdução
Apesar da importância da quiralidade, a obtenção de moléculas quirais na forma enantiomericamente pura permaneceu extremamente limitada até muito recentemente. Desde o final do século XIX, a síntese de moléculas quirais de maneira estereosseletiva tem sido um desafio sintético de grande magnitude ao qual os químicos orgânicos têm respondido com grande engenhosidade e brilhantismo.
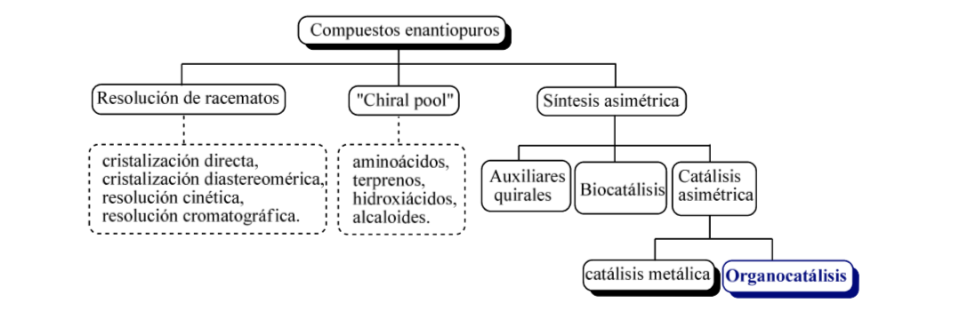
Em linhas gerais, três estratégias básicas podem ser consideradas para a obtenção de compostos enantiomericamente puros, como
a) a resolução de racematos,
b) o uso de moléculas naturais opticamente ativas
c) síntese assimétrica.
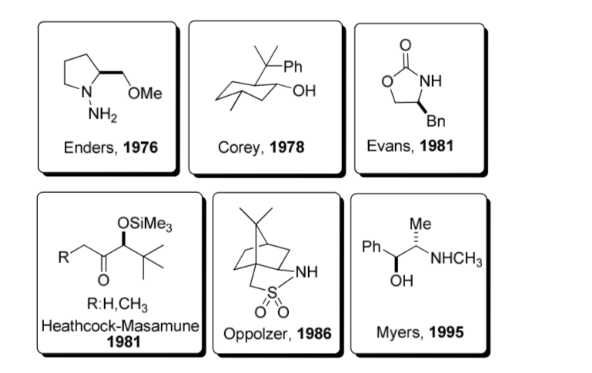
Uso de auxiliares quirais:
Um auxiliar quiral é um composto ou unidade química que é temporariamente incorporada a uma síntese orgânica para que possa ser realizada de forma assimétrica, com a formação seletiva de um dos dois enantiômeros.
Essa estratégia ganhou popularidade considerável na década de 1980 e hoje uma ampla gama de auxiliares é conhecida por um grande número de reações. Alguns dos auxiliares mais representativos são mostrados na figura
O que é organocatálise assimétrica?
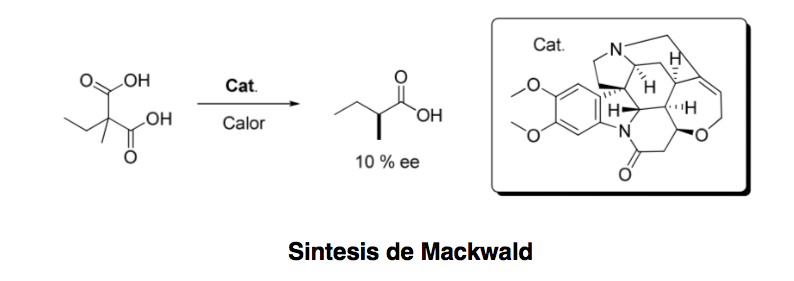
Organocatálise assimétrica ou catálise assimétrica pode ser definida como "a aceleração de reações químicas com uma quantidade subestequiométrica de um composto orgânico, que não contém nenhum átomo de metal usando moléculas orgânicas de natureza quiral". remontando a 1904, quando Mackwald realizou a descarboxilação de um derivado de ácido na presença de brucina, não foi até alguns anos atrás que este campo experimentou um renascimento espetacular.
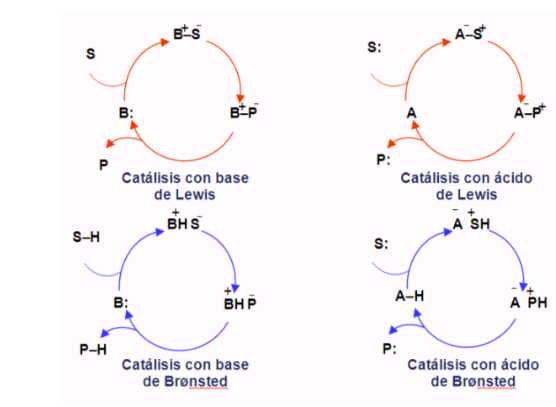
Ciclos organocatalíticos
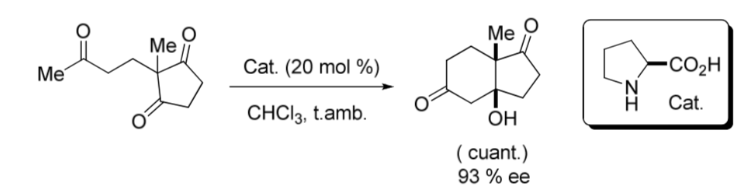
Um marco importante na área de organocatálise assimétrica foi a reação aldólica intramolecular catalisada por L -Prolina publicada no final dos anos 1960 e início dos anos 1970 pelos grupos Hajos e Parrish; e por outros Ender, Wiechert e Sauer independentemente como mostrado a seguir imagem:
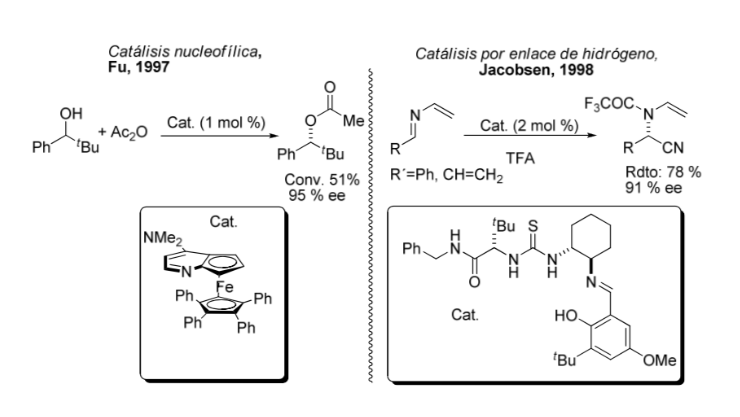
Comparação entre catálise organometálica e assimétrica:
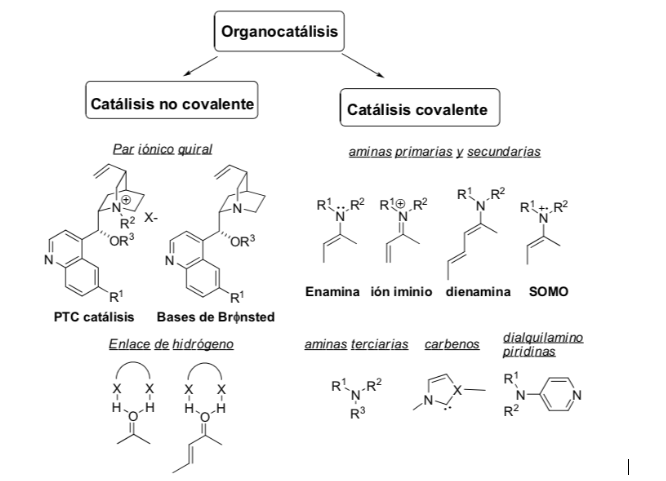
Método de ativação:
Fontes para expandir a pesquisa:
Berkessel, A. e Groeger, H. Organocatálise assimétrica: de conceitos biomiméticos a aplicações em síntese assimétrica” , Wiley-VCH: Weinheim, 2005.
Bui, T., Syed, S. e Barbas, CF, Tiourea-Catalyzed Highly Enantio- e Diastereoselective Additions of Oxindoles to Nitroolefins: Application to the Formal Synthesis of (+)-Physostigmine, J. Am. Chem. Soc . 131 , 8758-8759, 2009.
Hernández-Rodríguez, M. e Juaristi, E., Tiouréias quirais estruturalmente simples como agentes solvatantes quirais na enantiodiscriminação de ácidos carboxílicos, Tetrahedron 63 , 7673-7678, 2007.
Juaristi, E. Prêmio Nobel de Química 2001: A importância da síntese assimétrica, Educ. quím . 13 , 6-7, 2002. .
Juaristi, E. Síntese assimétrica de aminoácidos valiosos, em contribuições científicas e humanísticas mexicanas no século XX , Paredes, O. e Estrada, S., Eds., Fondo de Cultura Económica: México, 2008, p. 440-446.
Juaristi, E. Síntese enantioseletiva de â -aminoácidos , Wiley-VCH: Nova York, 1997.
Juaristi, E. e Soloshonok, VA (Eds.) Segunda edição da síntese enantiosseletiva de β -aminoácidos , Wiley: Nova York, 2005. Liu, Y., Melgar, R. e Juaristi, E. Aminação enantiosseletiva de
á-fenil á-cianoacetato catalisado por aminas quirais incorporando o auxiliar á-feniletilo, J. Org. Chem. Chem. 72 , 1522-1525, 2007.
MacMillan, DWC, O advento e desenvolvimento da organocatálise, Nature 455 , 304-308, 2008.
Marigo, M., Juhl, K., e Jorgensen, KA, catalítico, altamente enantiosseletivo, aminação direta de beta-cetoésteres, Angew. Chem., Int. Ed. 42 , 1367-1369, 2003.
Mukherjee, S.; Yang, JW; Hoffman, S.; List, B., catálise de enamina assimétrica, Chem. Rev. 107 , 5471-5569, 2007.
Olivares-Romero, JL e Juaristi, E., Síntese de duas novas diaminas quirais derivadas de ( S )-prolina e sua avaliação como precursores de diazaborolidinas para a redução enantiosseletiva mediada por borano catalítico de cetonas proquirais, Tetrahedron 64, 9992-9998, 2008.
Seayad, J. e List, B., Organocatálise assimétrica, Org. Biomol. Chem. 3 , 719-724, 2005.
Simon, L. e Goodman, JL, Mecanismo de BINOL-Phosphoric Acid-Catalyzed Strecker Reaction of Benzyl Imines, J. Am. Chem. Soc. 131 , 4070-4077, 2009.
Tanaka, K., Mori, A. e Inoue, S., O dipeptídeo cíclico ciclo[( S )-fenilalanil-( S )-histidil] como um catalisador para adição assimétrica de cianeto de hidrogênio a aldeídos, J. Org. Chem. 55 , 181-185, 1990.