asymmetrische Organokatalyse
Einführung
Trotz der Bedeutung der Chiralität blieb die Gewinnung chiraler Moleküle in enantiomerenreiner Form bis vor kurzem äußerst begrenzt. Seit dem Ende des 19. Jahrhunderts war die stereoselektive Synthese chiraler Moleküle eine synthetische Herausforderung von großem Ausmaß, auf die organische Chemiker mit großem Einfallsreichtum und Brillanz geantwortet haben.
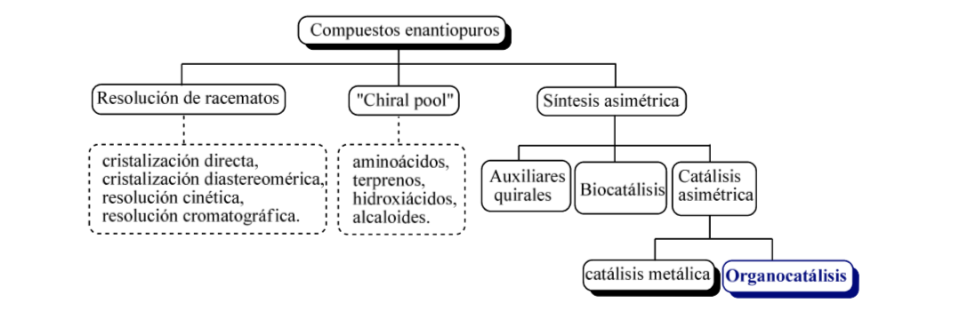
In groben Zügen können drei grundlegende Strategien in Betracht gezogen werden, um enantiomerenreine Verbindungen zu erhalten, wie z
a) Racematspaltung,
b) die Verwendung natürlicher optisch aktiver Moleküle
c) asymmetrische Synthese.
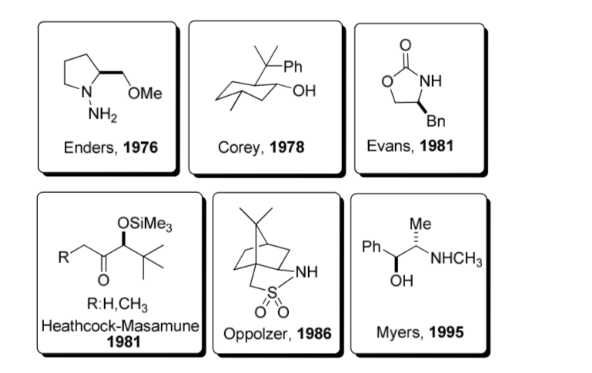
Verwendung chiraler Hilfsstoffe:
Ein chiraler Hilfsstoff ist eine chemische Verbindung oder Einheit, die vorübergehend in eine organische Synthese eingebaut wird, damit diese asymmetrisch unter selektiver Bildung eines von zwei Enantiomeren durchgeführt werden kann.
Diese Strategie erlangte in den 1980er Jahren beträchtliche Popularität, und heute ist ein breites Spektrum an Hilfsstoffen für eine Vielzahl von Reaktionen bekannt. Einige der repräsentativsten Hilfsstoffe sind in der Abbildung dargestellt
Was ist asymmetrische Organokatalyse?
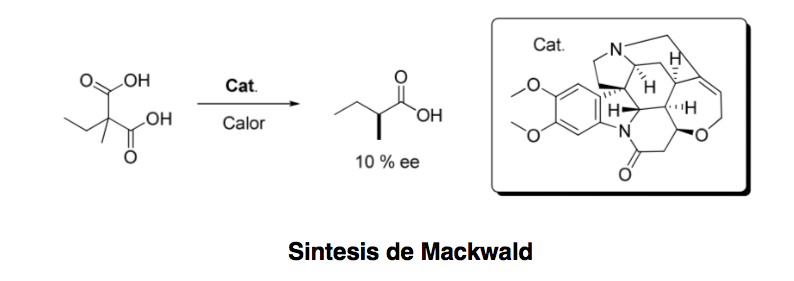
Asymmetrische Organokatalyse oder asymmetrische Katalyse kann definiert werden als „die Beschleunigung chemischer Reaktionen mit einer substöchiometrischen Menge einer organischen Verbindung, die keine Metallatome enthält, unter Verwendung organischer Moleküle chiraler Natur.“ Obwohl das erste Beispiel einer organokatalytischen enantioselektiven Transformation Datierung zurück bis 1904, als Mackwald die Decarboxylierung eines Säurederivats in Gegenwart von Brucin durchführte, erlebte dieses Gebiet erst vor einigen Jahren einen spektakulären Aufschwung.
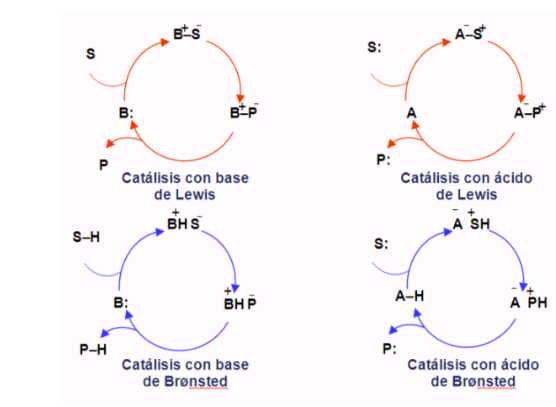
Organokatalytische Kreisläufe
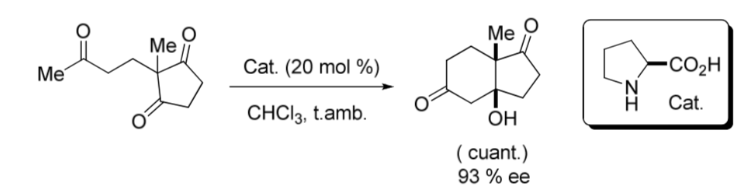
Ein wichtiger Meilenstein auf dem Gebiet der asymmetrischen Organokatalyse war die in den späten 1960er und frühen 1970er Jahren von den Hajos- und Parrish-Gruppen veröffentlichte intramolekulare Aldolreaktion, die durch L -Prolin katalysiert wurde; und unabhängig davon von Ender, Wiechert und Sauer, wie im Folgenden gezeigt wird Bild:
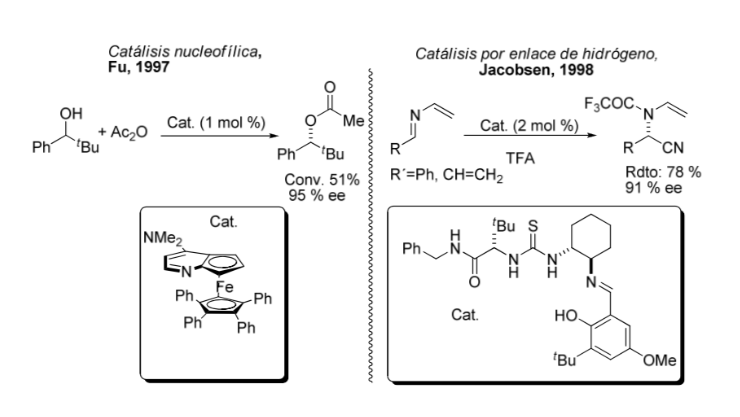
Vergleich zwischen metallorganischer und asymmetrischer Katalyse:
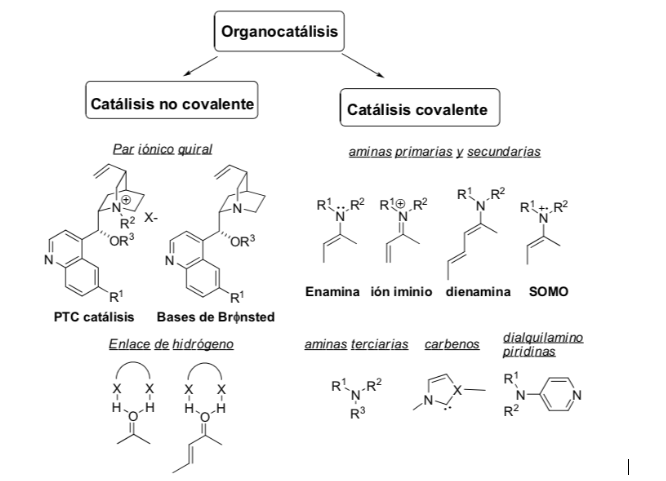
Aktivierungsmethode:
Quellen zur Erweiterung der Suche:
Berkessel, A. und Groeger, H. Asymmetrische Organokatalyse: von biomimetischen Konzepten zu Anwendungen in der asymmetrischen Synthese“ , Wiley-VCH: Weinheim, 2005.
Bui, T., Syed, S. und Barbas, CF, Thiourea-Catalyzed Highly Enantio- and Diastereoselective Additions of Oxindoles to Nitroolefins: Application to the Formal Synthesis of (+)-Physostigmine, J. Am. Chem. Soc . 131 , 8758-8759, 2009.
Hernández-Rodríguez, M. und Juaristi, E., Strukturell einfache chirale Thioharnstoffe als chirale Solvatisierungsmittel bei der Enantiodiskriminierung von Carbonsäuren, Tetrahedron 63 , 7673-7678, 2007.
Juaristi, E. Nobelpreis für Chemie 2001: Die Bedeutung der asymmetrischen Synthese, Educ. quím . 13 , 6-7, 2002. .
Juaristi, E. Asymmetrische Synthese wertvoller Aminosäuren, in mexikanischen wissenschaftlichen und humanistischen Beiträgen im 20. Jahrhundert , Paredes, O. und Estrada, S., Hrsg., Fondo de Cultura Económica: México, 2008, p. 440-446.
Juaristi, E. Enantioselektive Synthese von â -Aminosäuren , Wiley-VCH: New York, 1997.
Juaristi, E. und Soloshonok, VA (Hrsg.) Zweite Ausgabe von enantioselektive Synthese von â -Aminosäuren , Wiley: New York, 2005. Liu, Y., Melgar, R. und Juaristi, E. Enantioselective aminierung of
α-Phenyl-α-cyanacetat, katalysiert durch chirale Amine unter Einbau des α-Phenylethyl-Auxiliars, J. Org. Chem. 72 , 1522–1525, 2007.
MacMillan, DWC, The advent and development of organo-catalysis, Nature 455 , 304-308, 2008.
Marigo, M., Juhl, K., und Jorgensen, KA, Catalytic, high enantioselective, direct amining of beta-ketoesters, Angew. Chem., Internationale Ausgabe 42 , 1367–1369, 2003.
Mukherjee, S.; Yang, JW; Hoffmann, S.; List, B., Asymmetric enamine catalysis, Chem. Rev. 107 , 5471-5569, 2007.
Olivares-Romero, JL und Juaristi, E., Synthesis of Two Novel Chiral Diamines Derived from ( S )-Proline and their Evaluation as Precursors of Diazaborolidines for the Catalytic Borane-Mediated Enantioselective Reduction of Prochiral Ketones, Tetrahedron 64, 9992-9998, 2008.
Seayad, J. und List, B., Asymmetric organocatalysis, Org. Soc. Biomol. Chem. 3 , 719–724, 2005.
Simon, L. und Goodman, JL, Mechanism of BINOL−Phosphoric Acid-Catalyzed Strecker Reaction of Benzyl Imines, J. Am. Chem. Soc. 131 , 4070-4077, 2009.
Tanaka, K., Mori, A. und Inoue, S., Das zyklische Dipeptid Cyclo[( S )-phenylalanyl-( S )-histidyl] als Katalysator für die asymmetrische Addition von Cyanwasserstoff an Aldehyde, J. Org. Chem. 55 , 181-185, 1990.