TRENNEN VON 1,4-DIOXYGENVERBINDUNGEN
Eine weitere Gruppe von Verbindungen von großer Bedeutung für die chemische Synthese sind dioxygenierte Moleküle, die in einem Abstandsverhältnis von 1,4 vorkommen. Diese Verbindungen erzeugen, wenn sie einer retrosynthetischen Trennungsanalyse unterzogen werden, Synthone, bei denen eines von ihnen, das Elektrophil oder das Nucleophil, als "anomal" oder "unlogisch" angesehen werden kann, da die einem der Atome zugeordnete Ladung nicht erklärt werden kann hinsichtlich seiner intrinsischen oder induzierten Elektronegativität.
1. 1,4-Disauerstoffverbindungen (1,4-diO)
Bei dieser Art von Verbindungen führt die Trennung auch zu einem logischen Synthon und zu einem anderen unlogischen (nicht natürlichen) Synthon, das ein Nucleophil oder ein Elektrophil sein kann, dessen synthetisches Äquivalent noch angemessen überarbeitet werden muss, um verwendet zu werden die reaktion chemie.
1. 1. Verbindungen 1,4-Dicarbonyl
1.1.1. 1,4-Diketonverbindungen
Die Trennungsalternativen dieser Art von zu synthetisierenden Verbindungen oder Molekülen (MOb) können zu folgenden Optionen führen:
Zu. Ein logisches Anionensynthon und ein unlogisches Kationensynthon
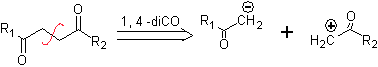
Das synthetische Äquivalent des Anions ist das Enolat-Ion oder das Enol selbst der Carbonylverbindung. Stattdessen ist das synthetische Äquivalent für das Carbokation Alpha-Halocarbonyl. (Umpolung)
B. Ein logisches Kationensynthon und ein unlogisches Anionensynthon
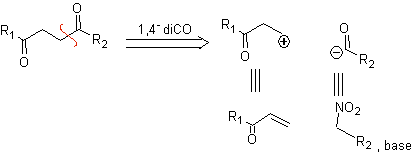
Das synthetische Äquivalent des logischen Kationensynthons ist die α,β-ungesättigte Carbonylverbindung. Ein geeignetes synthetisches Äquivalent für das Anionen-Synthon kann ein Nitroalkan-Anion sein. Die -NO 2 -Gruppe in Alkanen kann durch die Nef-Reaktion oder durch die Variante der McMurry-Reaktion, bei der durch Einwirkung von TiCl 3 das Nitroalkan in ein Imin umgewandelt wird, das dann It ist, in C=O umgewandelt werden in saurem Medium zur jeweiligen Carbonylverbindung hydrolysiert wird.
1.1.2.
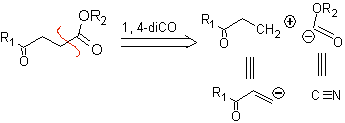
1,4-Ketoester-Verbindungen
γ-Ketoester, 1,4-Diester und 1,4-Disäuren können an ein natürliches Kationensynthon, dessen synthetisches Äquivalent eine α,β-ungesättigte Carbonylverbindung ist, und an das nicht-natürliche („unlogische“) ) Anionensynthon (-) COOR, dessen synthetisches Äquivalent das Cyanidion ist.
Beispiele: Schlagen Sie ein Synthesedesign aus einfachen und erschwinglichen Materialien für jedes der folgenden Moleküle vor:
MB 35
| MB 36
| |
MB 37
| MB 38
|
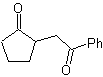
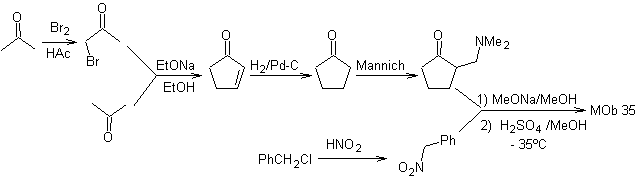
MOb 35 (a). Retrosynthetische Analyse . Das Molekül kann nach dem 1,4-diCO-Modell getrennt werden. Das erzeugte Vorläufer-Cyclopentanon muss zuvor aktiviert werden, damit sein Cα nukleophiler wird, und dann in der Reaktion mit α.Bromaceton verwendet werden.
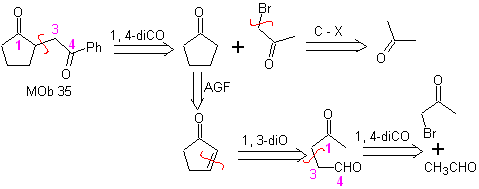 Synthese . Die Nucleophilie von Cyclopentanon wird kontrolliert und garantiert, indem LDA verwendet wird, um zu erreichen
Synthese . Die Nucleophilie von Cyclopentanon wird kontrolliert und garantiert, indem LDA verwendet wird, um zu erreichen
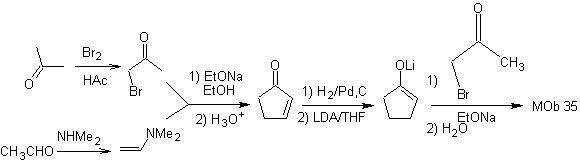
MOb 35 (b). Retrosynthetische Analyse . Das 1,4-diCO-Modell, das sich präsentiert
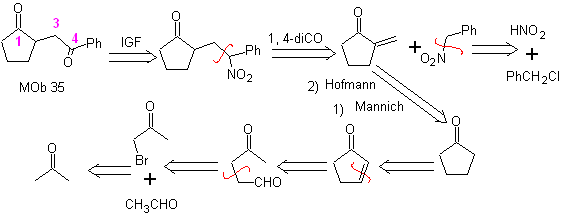
Synthese . Ebenso ist die letzte Etappe zu erreichen
Die Verwendung von sekundären Nitroalkanen oder Nitroarenen erzeugt durch die Nef-Reaktion Ketone als Produkt, weshalb diese Methodik nur auf 1,4-Ketoester, 1,4-Ketone und 1,4-Ketoaldehydverbindungen anwendbar ist.
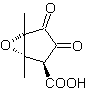
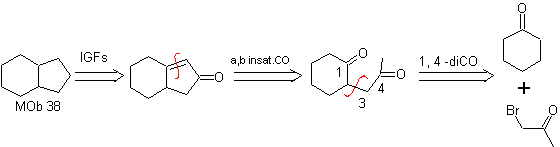
MOb 36. Retrosynthetische Analyse. In erster Linie die Carboxylgruppe von
Es versteht sich, dass die Doppelbindung im Ring gegenüber Epoxidation reaktiver ist als die andere Doppelbindung. Die anschließende Trennung von α,β-Insat-CO ermöglicht die Bildung einer Struktur, die durch die Modelle leichter zu trennen ist in den intermediären Molekülen erzeugte Dioxygenate.
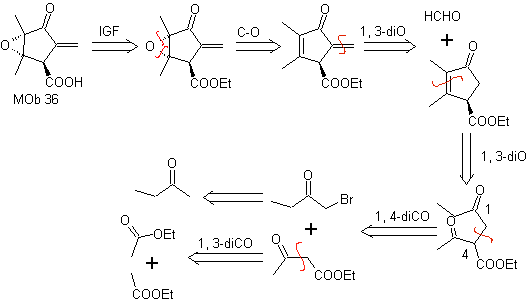
Synthese. Die einzige Sorgfalt, die bei dieser Synthese beachtet werden muss, ist die Epoxidierung der Ringdoppelbindung, die reaktiver als die Vinyldoppelbindung ist, dann die Reaktionen, um die Synthese zu erreichen
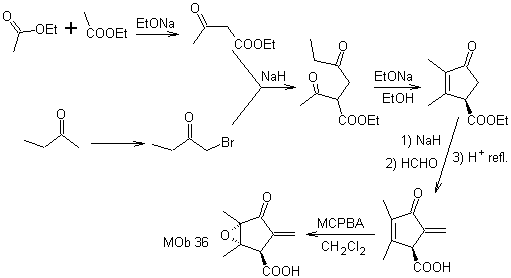
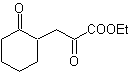
MOb 37. Retrosynthetische Analyse: Die Trennung von
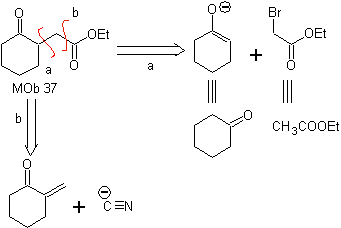
Synthese : Trennung (a) folgt. Hydrolyse
am Ende muss es kontrolliert werden
keinen Einfluss auf die Estergruppe von MOb 37
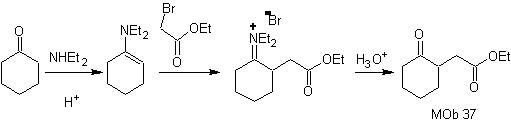
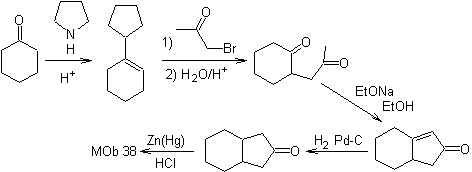
Synthese .
Das Enamin von Cyclohexanon wird erneut verwendet, um das Halogen des Ketons zu verdrängen. Die gebildete 1,4-diCO-Verbindung wird im basischen Medium cyclisiert.
2.1.2.
g - Hydroxycarbonylverbindungen
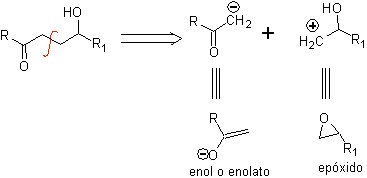
Eine γ-Hydroxycarbonylverbindung entspricht dem 1,4-diO-Modell, weshalb ihre Trennung ein logisches anionisches Synthon und ein unlogisches kationisches Synthon liefert, deren synthetisches Äquivalent ein Epoxid sein kann.
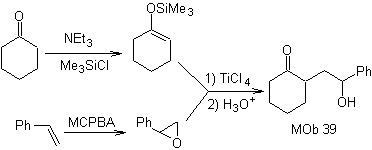
Wie könnte das folgende Molekül synthetisiert werden? | MB 39
|
MOb 39. Retrosynthetische Analyse.
Die Trennung des Modells
Aus γ-Hydroxycarbonyl, MOb 39, entsteht Cyclohexanon als Vorläufermolekül und ein aromatisches Epoxid. Sie müssen nach dem Enol oder Enolat des Ketons suchen, das sein Cα aktiviert, um das Epoxid auf der weniger gehinderten Seite zu öffnen.
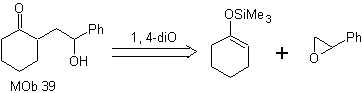
Synthese. Silylenether ist ein starkes Nucleophil, das in der Lage ist, ein Epoxid von der weniger geschützten Seite in einem sauren Medium und katalysiert durch Ti(IV)-Salz anzugreifen.