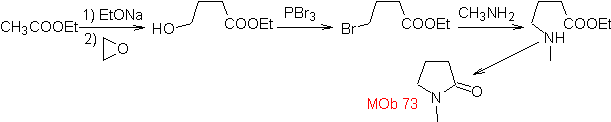SYNTHESE VON HETEROZYKLEN DURCH INTRAMOLEKULARE ZYKLUSUNG
Der Aufbau von heterocyclischen Systemen verwendet ebenfalls diese gleichen Reaktionen, mit der Besonderheit, dass das heterocyclische System vorhanden sein muss oder mindestens ein anderes Atom als Kohlenstoff enthalten muss. Die häufigsten sind Stickstoff, Sauerstoff, Schwefel und Phosphor.
Das cyclische System des zu synthetisierenden Moleküls kann aus der Modifikation eines cyclischen Systems stammen, das in einem der an der Synthese beteiligten Reagenzien vorhanden ist, oder das Ergebnis der Cyclisierung nicht-cyclischer Vorläufer sein, die bei der Entwicklung der Synthese aufgebaut wurden durch intramolekulare Cyclisierung oder durch Methoden, die auf intermolekularen Cyclisierungen (Cycloadditionen) basieren.
1. Intramolekulare Cyclisierung
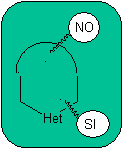
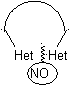
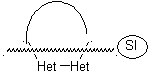
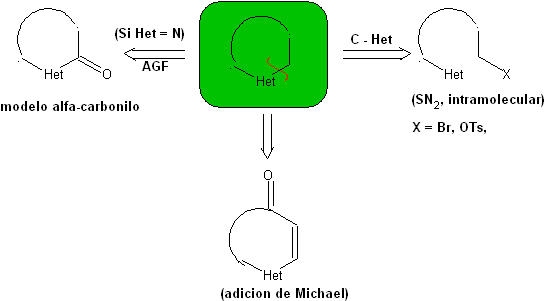
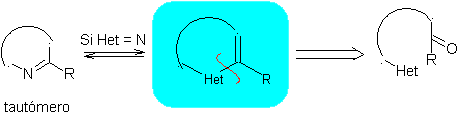
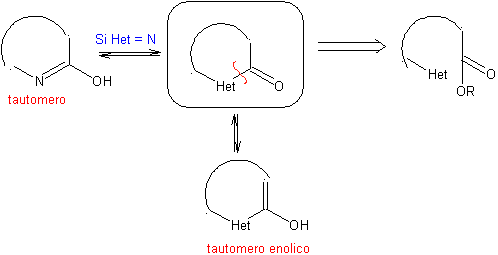
Die allgemeinen Regeln für die Trennung von Heterocyclen, die aus einer intramolekularen Cyclisierung stammen, wurden von JI Borrell angemessen systematisiert , die gleichen wie in diesem Abschnitt angenommen (Het = N, O, S)
1.
Bei der Synthese einer monocyclischen Verbindung beinhaltet der Ringschluss im Allgemeinen die Bildung einer Kohlenstoff-Heteroatom-Bindung.
Modell: |
|
Beispiel: |
|
|
|
Beispiel : |
|
Modell: |
|
Beispiel: |
|
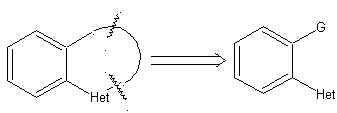
1.1. Modelle für intramolekulare Cyclisierung
Drei Modelle für die intramolekulare Cyclisierung und die entsprechenden Trennungen können genannt werden:
Gesättigtes Modell:
| α-ungesättigtes Modell
| α-Carbonyl-Modell
|
1.1.1.
gesättigtes Modell
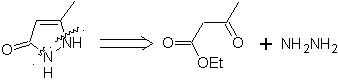
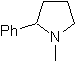
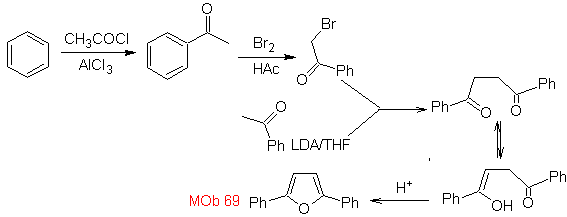
Schlagen Sie ein Synthesedesign aus einfachen und erschwinglichen Materialien für die folgenden Moleküle vor:
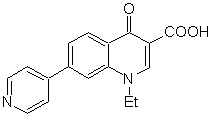
MB 65
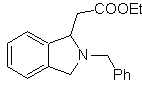
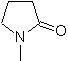
| … | MB 66
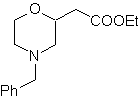
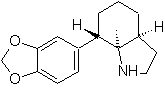
| … | Mob 67
|
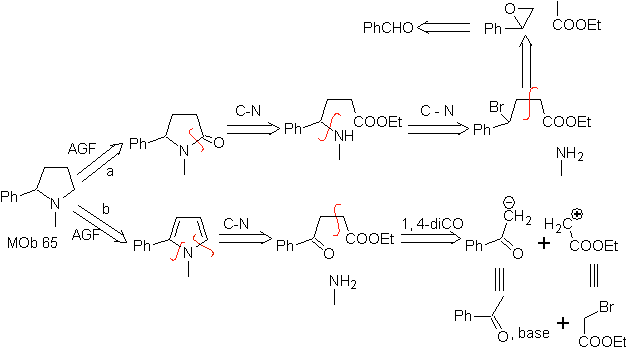
Synthese. Es beginnt einerseits mit der Friedel-Crafts-Acylierung von Benzol und andererseits mit der Bromierung von Ethylacetat, laut HVZ.Die folgenden Schritte erfordern Arbeiten im basischen Medium, und am Ende geht es weiter zur Hydrierung ungesättigter Zentren erreichen
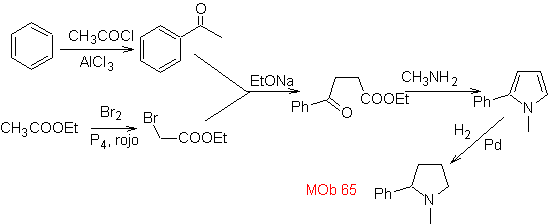
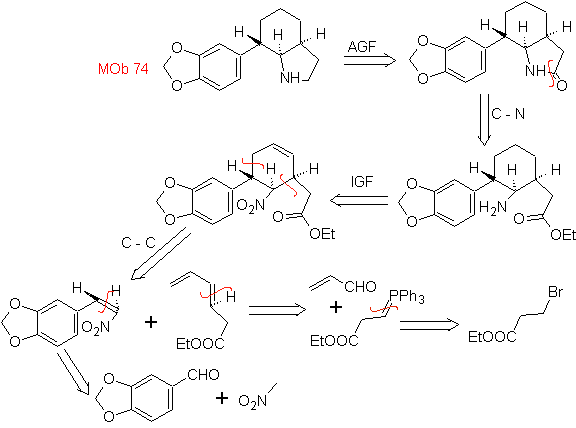
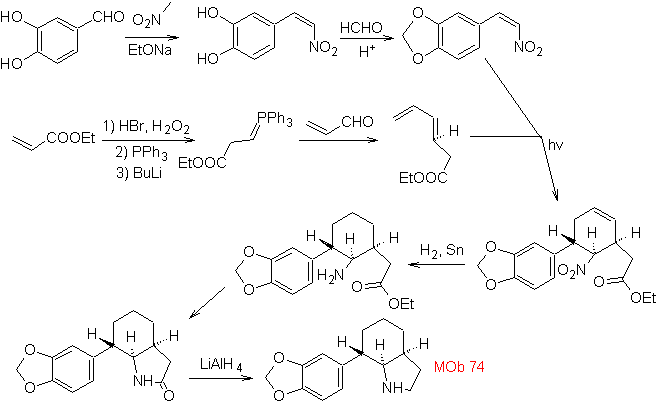
Mob. 66. Retrosynthetische Analyse . Der Angriff des nukleophilen N auf das β-Kohlenstoffatom in Bezug auf die Estergruppe (MOb 66) lässt vermuten, dass es durch eine intramolekulare konjugierte Michael-Addition eines Amins an einen α,β-ungesättigten Ester gebildet wurde. Die C-N-Unterbrechung führt zu anderen üblichen Unterbrechungen, bis einfache Ausgangsmaterialien erreicht werden.
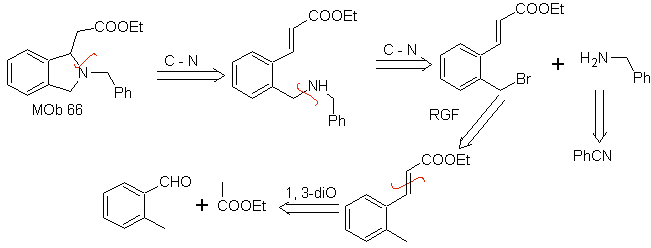
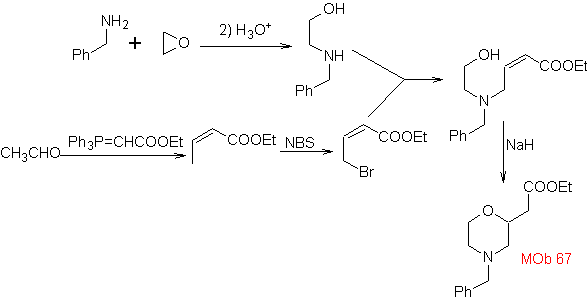
Synthese . Der o-Methylbenzaldehyd kann gegebenenfalls durch die Gattermann-Koch-Reaktion an para-Methylsulfonsäure hergestellt werden. Der Rest der Reaktionen, für die Synthese von
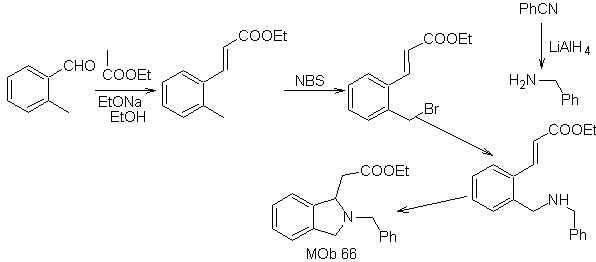
MOb 67. Retrosynthetische Analyse. Wie im vorigen Beispiel ist die CO-Bindung in β-Stellung zur Estergruppe, in
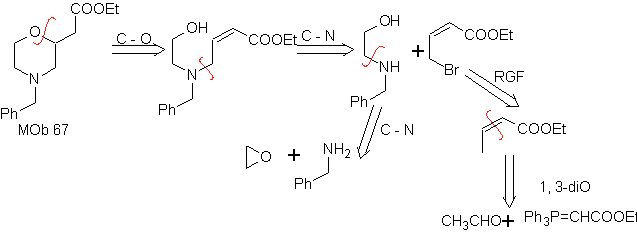
Synthese. Die Synthese von
1.1.2.
α-ungesättigtes Modell
Schlagen Sie ein Synthesedesign aus einfachen und erschwinglichen Materialien für die folgenden Moleküle vor:
MB: 68
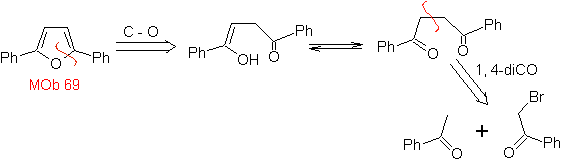
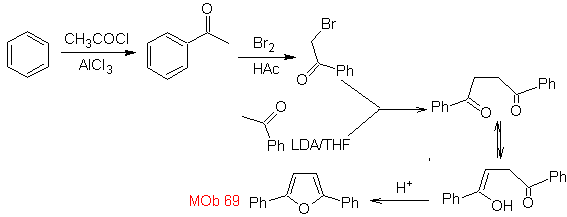
| MB: 69
| MB: 70
| MB: 71
|
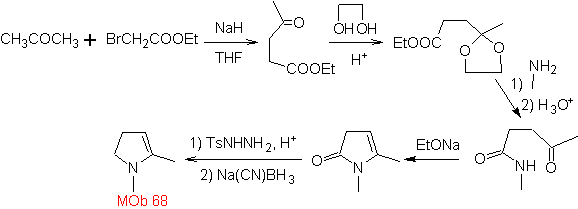
MOb 68. Retrosynthetische Analyse . Der Trennungsprozess
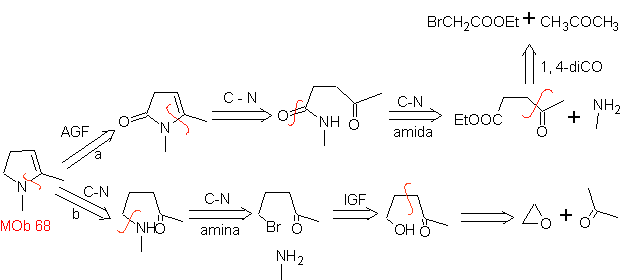
Synthese. Die Wege der Trennung, von
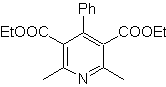
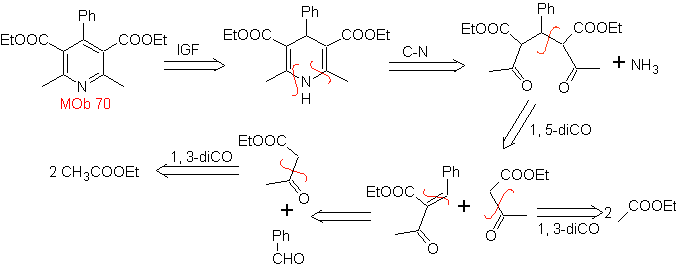
Mob. 70 . Retrosynthetische Analyse . Dieses MOb ist ein Pyridinderivat, dessen Struktur charakteristisch für die bei der Hansch-Pyridinsynthese gebildeten Produkte ist, d. h. der Pyridinzyklus muss aus einem Aldehyd und zwei Mol 1,3-diCO-Verbindung gebildet werden und das Zwischenprodukt Dihydrochinon oxidieren gebildet .
MB 71 . Retrosynthetische Analyse.
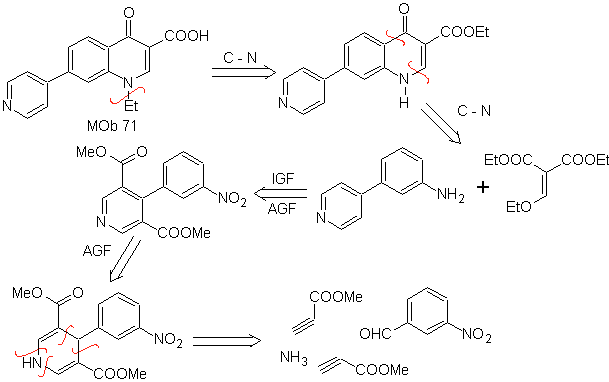
Die gleichzeitige Trennung am Keton und am Amin zeigt, dass das Anilin und die Carbonylverbindung kondensiert sind. Da die Einführung des Benzolrings in ein Pyridin unwahrscheinlich ist, wird die Strategie gewählt, den Pyridinring aus geeigneten Acetylidderivaten aufzubauen.
Synthese . Nitrilester ermöglichen zusammen mit m-Nitrobenzaldehyd eine intermolekulare Cyclisierung zur Bildung eines Hydropyridin-Derivats, das mit konzentrierter HNO 3 zu Pyridin oxidiert wird.
Dann er Nitrogruppe, ermöglicht den Aufbau des Chinolin-Pyridin-Rings durch Kondensationsreaktionen mit einer geeigneten diCO-Verbindung. ethylierung

Schlagen Sie einen Syntheseplan aus einfachen Materialien für die folgenden Moleküle vor:
MB: 72
| MB: 73
| MB: 74
|
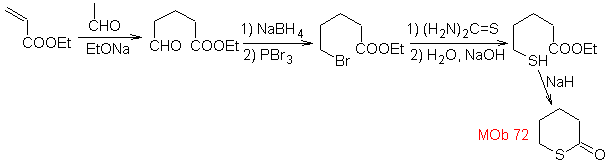
MOb 72. Retrosynthetische Analyse . Das MOb ist ein Tetrahydropyranon, es ist durch die S-CO-Bindung getrennt. Die folgenden IGFs ermöglichen die Bildung eines 1,5-diCO-Vorläufers, der, wenn er getrennt wird, die Ausgangsmaterialien liefert.
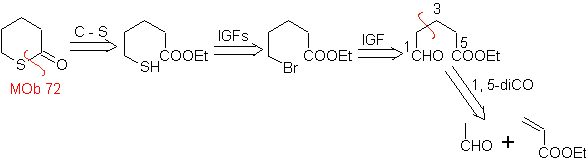
MOb 73. Retrosynthetische Analyse . Die Trennung der Lactam-Amido-Bindung erzeugt das erste Vorläufermolekül, das ein γ ist. Aminoester, der zwischen einem primären Amin und dem gebildet wird γ-Bromester und folglich γ-Hydroxyester, der zwischen Ethylacetatenolat und einem Epoxid umgesetzt wird, als einfache und erschwingliche Ausgangsmaterialien.
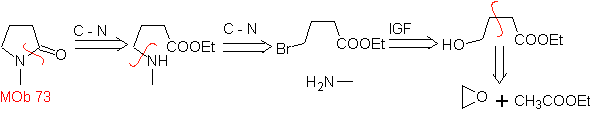
Synthese : Das Epoxid und Acetat Ethyl sind die Reaktanten, die reagieren, um den γ -Hydroester zu bilden. Das OH wird mit PBr 3 durch Brom ersetzt und dieses reagiert mit Methylamin. um das Vorläufermolekül, das sich in einem Lactamring schließt, zu bilden