-
Détails
-
Germán Fernández
-
FORMULES MOLÉCULAIRES
-
Affichages : 87354
Actuellement, plus de 30 millions de composés chimiques sont connus, dont 1 million sont inorganiques et le reste est organique. Les chimistes déterminent les propriétés physiques et chimiques de ces substances (points de fusion et d'ébullition, solubilité, densité...). Cependant, l'information la plus convoitée par le chimiste est la détermination de la structure du composé, de quel type d'atomes le compose et comment ces atomes sont liés.
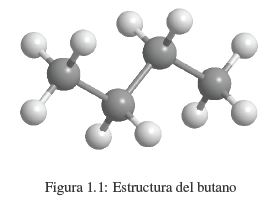
Nous savons qu'une substance comme le butane est composée de carbone et d'hydrogène. Chaque molécule contient 4 atomes de carbone et 10 atomes d'hydrogène, représentés par la formule C 4 H 10 , appelée formule moléculaire. Nous savons également que les atomes de carbone sont liés pour former une chaîne linéaire. 3 hydrogènes sont attachés au premier carbone, 2 hydrogènes au deuxième carbone, 2 hydrogènes au troisième carbone et les 3 derniers hydrogènes au quatrième carbone.
Lire la suite : Formules moléculaires
-
Détails
-
Germán Fernández
-
FORMULES MOLÉCULAIRES
-
Affichages : 97562
Elle consiste à déterminer expérimentalement la composition en pourcentage (en masse) d'une substance. Ainsi, pour un composé de formule moléculaire C 4 H 10 la composition en pourcentage est de : 82,66 % C et 17,34 % H.
L'analyse élémentaire d'un composé est réalisée dans un appareil, appelé analyseur, où un échantillon pesé est brûlé avec une grande précision (environ 5 mg). Le carbone est transformé en CO 2 , l'hydrogène en H 2 O et l'azote en N 2 , dosé par chromatographie en phase gazeuse. L'oxygène n'est généralement pas analysé et est déterminé par différence.
Lire la suite : Analyse élémentaire
-
Détails
-
Germán Fernández
-
FORMULES MOLÉCULAIRES
-
Affichages : 91002
A partir de la composition centésimale d'un composé chimique, nous pouvons déterminer sa formule empirique. La formule moléculaire est obtenue à partir de la formule empirique en utilisant la masse moléculaire du composé, qui peut être déterminée par spectrométrie de masse.
Détermination de la formule empirique et moléculaire de la cortisone
La composition en pourcentage de la cortisone est de : 69,96 % de C ; 7,83 % H et 22,21 % O. Déterminer la formule empirique. Sachant que la masse moléculaire est de 360,43, obtenez la formule moléculaire.
Lire la suite : Calcul de formules empiriques et moléculaires
-
Détails
-
Germán Fernández
-
FORMULES MOLÉCULAIRES
-
Affichages : 83543
L'indice d'insaturation d'une molécule est défini comme la somme du nombre de liaisons \(\pi\) et du nombre de cycles présents. Les alcanes sont des hydrocarbures saturés car ils ne contiennent pas de liaisons ou de cycles \(\pi\) et ont la formule moléculaire \(C_nH_{2n+2}\). Pour calculer l'indice d'insaturation d'un composé, il suffit de comparer le nombre d'hydrogènes qu'il possède avec ceux qu'il aurait s'il s'agissait d'un alcane avec le même nombre de carbones. Cette différence d'hydrogène divisée par 2 nous donne l'indice d'insaturation.
Les alcènes sont des composés qui contiennent des doubles liaisons carbone-carbone. Les alcènes répondent à la formule moléculaire \(C_nH_{2n}\). A nombre de carbones égal ils ont deux hydrogènes de moins qu'un alcane, on dit qu'ils sont des composés insaturés (ils ont une insaturation).
Lire la suite : Indice d'insaturation