TRENNUNG VON 1,3-DIOXYGENVERBINDUNGEN
Oxygenierte organische Verbindungen kommen in der Natur am häufigsten vor, insbesondere Dioxygenate, weshalb viele chemische Forscher die retrosynthetische Trennung dieser Moleküle modelliert haben, ein Aspekt, der in den folgenden Abschnitten untersucht wird.
Zunächst wurden die Trennungsmodelle dioxygenierter Moleküle in zwei große Gruppen eingeteilt, basierend auf der Natur der Synthone, die durch die Anwendung einer grundlegenden synthetischen Operation namens " DISCONNECTION" auf das zu synthetisierende Molekül erzeugt werden, und zwar im Allgemeinen wird als Zielmolekül (MOb) bezeichnet.
Diese großen Gruppen sind:
![]() „ Logische “ Trennungsmodelle und
„ Logische “ Trennungsmodelle und
![]() „ Anormale “ oder „ unlogische “ Trennungsmodelle
„ Anormale “ oder „ unlogische “ Trennungsmodelle
Die sogenannten "logischen" Trennungsmodelle sind solche, die durch Anwendung einer "Unterbrechung" einer oder mehrerer chemischer Bindungen in
Verbindungen, die als 1,3-Disauerstoff und 1,5-Disauerstoff klassifiziert werden können, bilden, wenn sie einer Retrosynthese unterzogen werden, im Allgemeinen Synthone, die als "logisch" gelten. Andererseits erzeugen organische Moleküle, die mit 1,2-dioxygeniertem, 1,4-dioxygeniertem und 1,6-dioxygeniertem verwandt sind, Synthone
als „unlogisch“ angesehen
Cut-off-Modell 1,3-Disauerstoff
![]() β-Dicarbonylverbindungen
β-Dicarbonylverbindungen
Die 1,3-Dicarbonylverbindungen werden mit guten Ausbeuten durch Kondensationsreaktionen vom Claisen-Typ erhalten, die die Reaktion zwischen Estern und Verbindungen mit aktiven Wasserstoffatomen beinhalten, wie beispielsweise: Ester, Ketone, Aldehyde, Nitrile, Nitroderivate und einige Kohlenwasserstoffe in Gegenwart von alkalische Reagenzien.
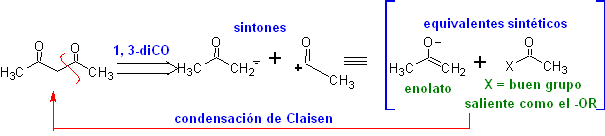
Die β-Diketone und β-Ketoaldehyde werden durch die gekreuzte Claisen-Kondensation unter Verwendung eines geeigneten Ketons und Esters erhalten. Bei der gekreuzten Claisen-Kondensation von Ketonen und Estern werden gute Ausbeuten erhalten, weil Ketone deutlich saurer sind als Ester, daher wird im basischen Medium das Keton stärker deprotoniert als der Ester.
Beispiele : Schlagen Sie ein Synthesedesign aus einfachen Materialien für die folgenden Moleküle vor:
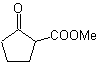
MB 16
| Mob 17
| MB 18
|
Lösung:
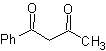
MB 16 . Anscheinend sind die beiden Abschaltalternativen (a) und (b), dargestellt in
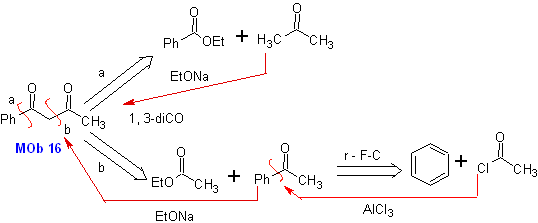
Alternative (b) erweist sich jedoch als die geeignetste, da im basischen Reaktionsmedium das gebildete Carbanion PhCOCH 2 – aufgrund von Resonanz- und Induktionseffekten besser stabilisiert würde.
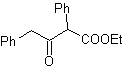
MOb 17. Unterbrechung (a), in
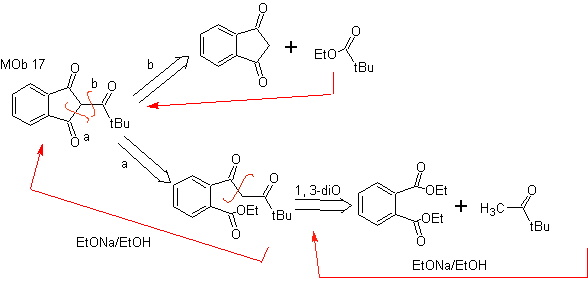
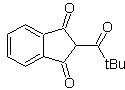
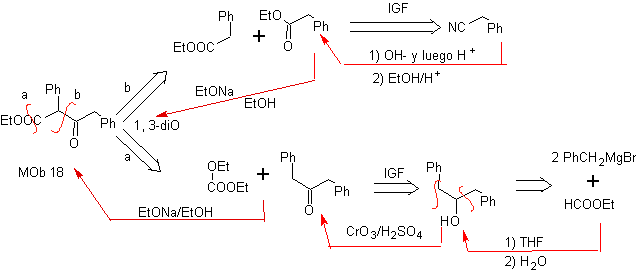
MOb 18. Die beste Trennungsalternative in diesem MOb ist (b), weil sie zu symmetrischen synthetischen Äquivalenten führt. die Alternative (a) ist bei der Verwendung von Ethylformiat nicht ohne Bedeutung.
![]() β-Dicarbonylverbindungen durch intramolekulare Kondensationen
β-Dicarbonylverbindungen durch intramolekulare Kondensationen
Schlagen Sie einen durchführbaren Syntheseplan für die folgenden Moleküle vor: | Mob 19
| Mob 20
|
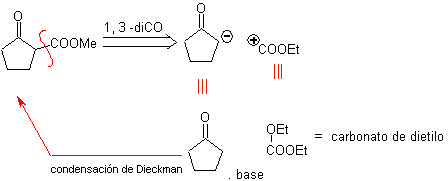
MOb 19. Die Trennung 1,3–diCO, führt zu einem Diester in Relation 1,6. Sie lassen sich leicht wieder mit einem Alkenhexacyclus verbinden, ein Modell, das etwas später untersucht wird. Aus diesem Grund wird basierend auf bekannten Reaktionen ein alternatives Synthesedesign bereitgestellt.
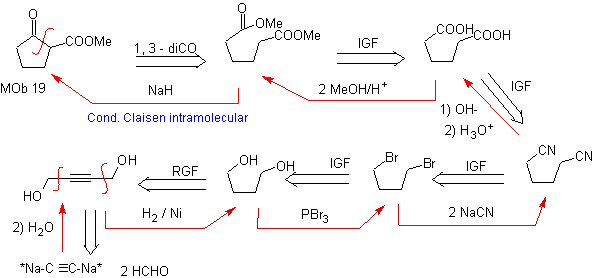
Design, das nur durch die große Anzahl von Schritten in Frage gestellt werden kann, was im Allgemeinen die Ausbeute der Synthese verringert.
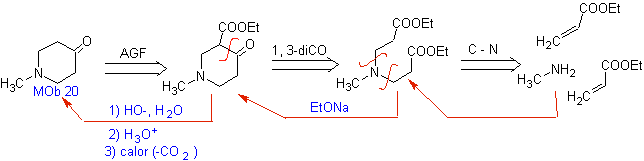
Es ist möglich, an eine andere Trennung zu denken 1, 3 – diCO für
MB 20 . Manchmal ist es notwendig, die Struktur von zu kontrollieren
So,
![]() Beta -Hydroxy-Verbindungen
Beta -Hydroxy-Verbindungen
MOb21 . Die beste Trennung in Beta-Hydroxy-Verbindungen erfolgt durch die Bindung, die zwischen C bis gebildet wird
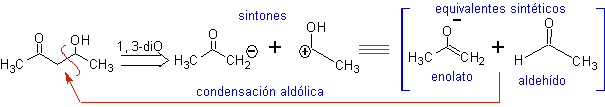
Und C b , bezogen auf die Carbonylgruppe. Diese Arten von Verbindungen sind typische Produkte von Aldolkondensationsreaktionen und dergleichen, weshalb ein gutes Synthesedesign z
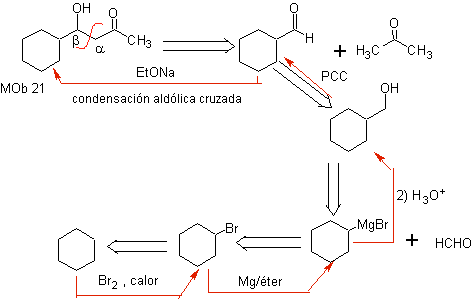
Die zur Bildung der b -Hydroxycarbonyle zu verwendende Base muss schwach sein, um eine Dehydratisierung der Alkoholfunktion zu vermeiden und somit eine a , b- ungesättigte Carbonylverbindung herzustellen, die Gegenstand unserer Untersuchung im nächsten Absatz sein wird.
Die Reaktion zwischen Formalcyclohexanon und Aceton in basischem Medium ist eine Kondensationsreaktion vom Aldoltyp. Die Aldehydgruppe ist am reaktivsten und es besteht keine Gefahr der Selbstkondensation des Aldehyds durch sterische Effekte.
![]() a , b ungesättigte Carbonylverbindungen ( a , b insat.CO )
a , b ungesättigte Carbonylverbindungen ( a , b insat.CO )
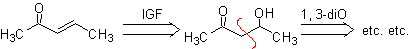
Die α,β-ungesättigten Carbonylverbindungen lassen sich leicht durch Dehydratisierung von β-Hydroxycarbonylverbindungen herstellen, weshalb ihre Trennung die Funktionalisierung des ungesättigten Moleküls zu einem Alkohol beinhaltet. Die olefinische Bindung könnte auch unter Verwendung der Wittig-Reaktion hergestellt werden.
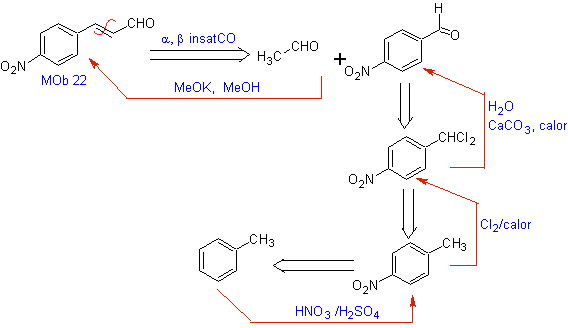
MOb 22. Da eine a,b-ungesättigte Carbonylverbindung , MOb 22 , zum entsprechenden Alkohol funktionalisiert werden kann, um ein 1,3-dioxygeniertes Modell zu erhalten, ist es möglich, das Molekül direkt durch die Doppelbindung zu trennen und ein C= zu formulieren O-Gruppe an Kohlenstoff b und eine -CH 3 -Gruppe an Kohlenstoff a .
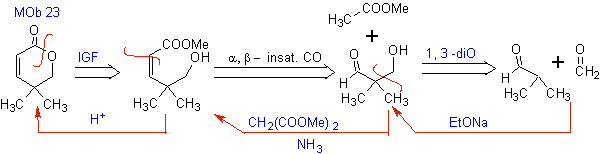
MOb 23. Die Trennung dieses Moleküls beginnt mit dem zyklischen Ester (Lacton), da dies der kritischste Punkt ist, der es dann ermöglicht, es als a , b- ungesättigte Carbonylverbindung zu trennen.
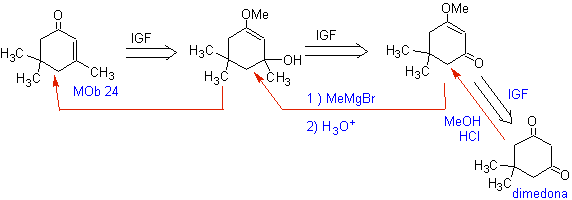
MOb 24. Die herkömmliche Trennung durch die Doppelbindung von