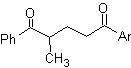
Die 1,5-dioxygenierten Verbindungen sind im Allgemeinen das Ergebnis von konjugierten Additionsreaktionen von Nucleophilen aus Carbonylverbindungen, mit saurem H α (Enole, Enolate, Enamine usw.), sowie Nitrile und Nitrate, an Substrate, die bezüglich alpha-beta ungesättigt sind zu Carbonylgruppen und dergleichen, bekannt als Michael-Reaktion, wobei komplementäre Optionen die Nef-Reaktion und die Robinson-Anellierungs-(Anellierungs-)Reaktion sind.
Trennen Modell 1, 5 Disauerstoff (1,5-diO)
Das 1,5-DiO-Entkopplungsmodell kann nach der notwendigen Funktionalisierung auf Verbindungen angewendet werden wie: 1,5-Dihydroxyle, 1,5-Hydroxyaldehyde, 1,5-Hydroxyketone, 1,5-Hydroxyester, 1,5- Ketoaldehyde, 1,5-Diketone, 1,5-Ketoester, 1,5-Dialdehyde usw.
Die Möglichkeiten steigen, wenn auch Nitroderivate und Nitrile berücksichtigt werden, die in einem basischen Medium sehr reaktive Carbanionen bilden können, die in der Lage sind, an α,β-ungesättigte Carbonylverbindungen zu addieren, um Produkte vom 1,5 -diO-Typ zu erhalten.
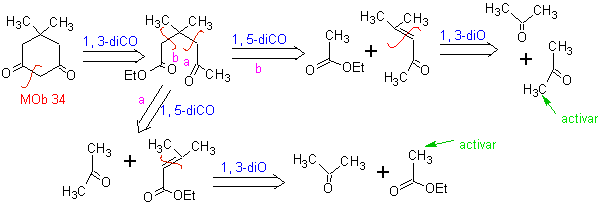
Die grundlegende Analyse der Trennung von 1,5-diO-Verbindungen lautet wie folgt:
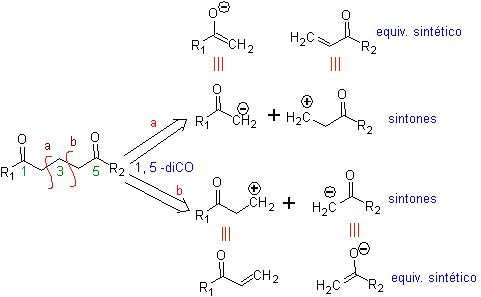
Die Wahl der Trennung (a) oder (b) um C3 hängt von der Art der R1- und R2-Gruppen ab, die dem Synthon oder synthetischen Äquivalent, das für die Bildung von notwendig ist, mehr oder weniger Stabilität verleihen können
Schlagen Sie ein Synthesedesign für MOb 29, 30 und vor
MB 29
| MOB 30
| Mob 31
|
Lösung:
MB 29 . Retrosynthetische Analyse: Das zur Addition an die a , b- ungesättigte Verbindung CO benötigte Carbanion Es kann aus Diethylmalonat in basischem Medium gewonnen werden. Das wird anschließend eine Decarboxylierung erzwingen, um zu erreichen
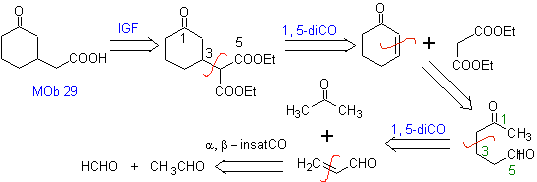
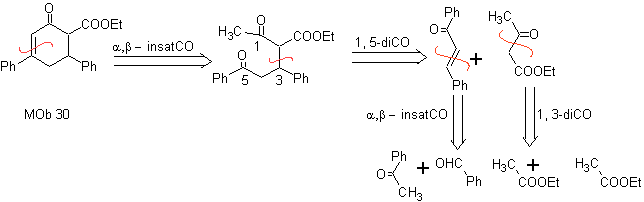
Synthese. Es geht weiter mit einer Kombination aus Claisen-Kondensationen, Claisen Schmidt , Michaels Reaktion und Robinsons Aufhebung, zu erreichen
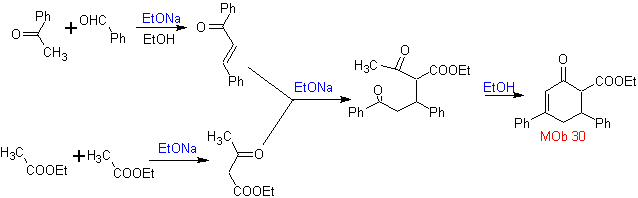
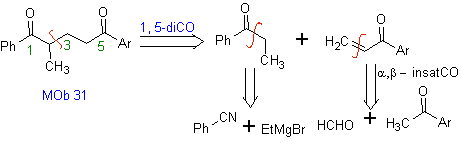
Vinylketone sind sehr reaktiv und neigen zur Dimerisierung durch die Diels-Alder-Reaktion, weshalb sie, wenn sie als Substrat in der Michael-Additionsreaktion benötigt werden, "in situ" hergestellt werden müssen und dafür eine sehr nützliche Reaktion darstellen ist die Mannich-Reaktion, wie im folgenden Beispiel zu sehen ist.
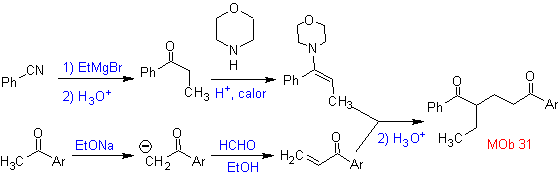
MB 32 . Retrosynthetische Analyse. Die anfängliche Anwendung des 1,5-diCO-Entkopplungsmodells erzeugt eine Vorstufe wie Vinylketon, das durch die Mannich-Reaktion, gefolgt von der Hoffmann-Eliminierung, gebildet werden muss, um sich mit dem durch die Claisen-Kondensation gebildeten Ketoester zu verbinden.
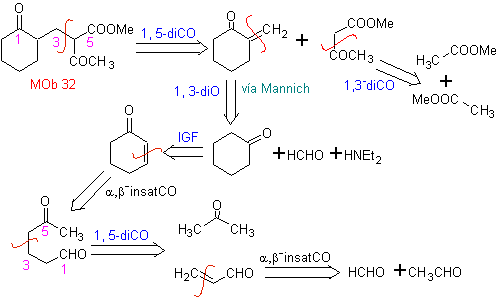
Synthese. Das für die (Michael)-Reaktion mit dem Ketoester notwendige Vinylketon wird durch geeignete Kombination der Mannich-Reaktion und der Hoffmann-Eliminierung hergestellt.
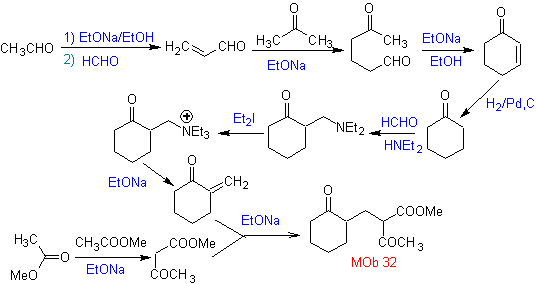
Synthese. Es muss kontrolliert werden, um das Nucleophil mit dem C 2º , das durch die Bildung des Enamins erreicht wird, mit einer ausreichend voluminösen Aminogruppe zu erzeugen. Das Produkt wird wie durch die Anellierung oder Robinson-Anellierung angegeben gebildet.
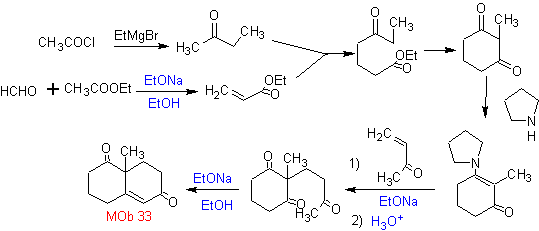
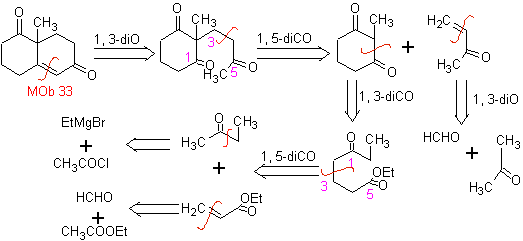
Die Robinson-Anellierung ermöglicht auch den Erhalt von cyclischen 1,3-Diketon-Verbindungen.
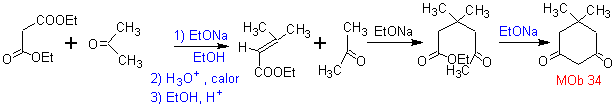
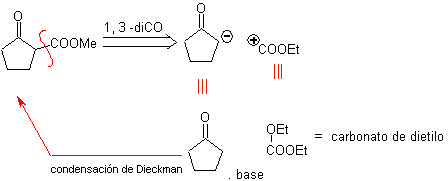
MOb 34. Retrosynthetische Analyse. Die 1,3-diCO-Entkopplung von