Andere Synthesestrategien, die „unlogische“ Syntons verwenden
1.
Dreifachbindungsaddition
Die Strategie des "Hinzufügens" einer Dreifachbindung zwischen zwei sauerstoffhaltigen Funktionen in Position 1,4 ermöglicht es, später mit einer Trennung zu arbeiten, die auf der Chemie von Acetyliden basiert. Um diese Strategie zu veranschaulichen, sehen wir uns die Ausarbeitung eines Syntheseplans für an
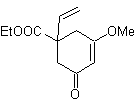
Mob. 40. Retrosynthetische Analyse . Ein erstes IGF in
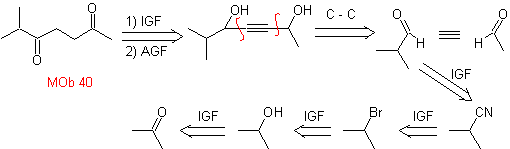
Synthese. Das Diacetylid oder Acetylid verbindet sich stufenweise mit Molekülen aus verschiedenen Aldehyden wird das gebildete Zwischenmolekül hydriert und anschließend werden seine Alkohole zur diketonischen Verbindung Mob 40 oxidiert.
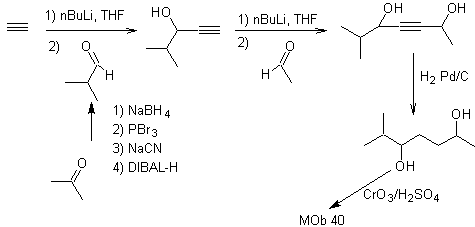
Die γ-Lactone können auch auf analoge Weise hergestellt werden, wie unten gezeigt:

2.
Hinzufügen der COOR-Gruppe als aktivierende Gruppe
Die Addition der COOR-Gruppe erleichtert zusätzlich zur Aktivierung des Anionensynthons die Trennung eines 1,4-diX-Moleküls.
synthetisieren |
|
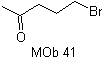
MOb 41. Retrosynthetische Analyse.
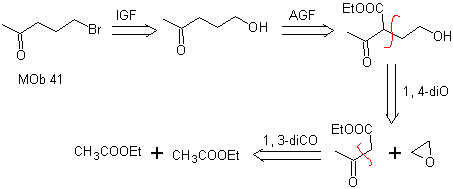
Synthese . Ethylacetoacetat ist ein Nucleophil, das das Epoxid in einem basischen Medium öffnet.
Die Estergruppe wird hydrolysiert und decarboxyliert, um zu gelangen
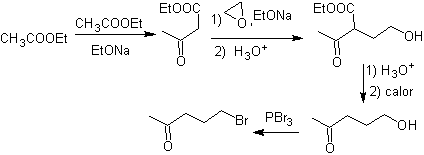
Schlagen Sie einen Syntheseplan für die folgenden Moleküle vor:
MB 42
| MB 43
| MB 44
|
MB 45
| MB 46
| MB 47
|
MB 42 . Retrosynthetische Analyse . Die 1,3-diO-Entkopplung von
Wacker-Oxidation: |
|
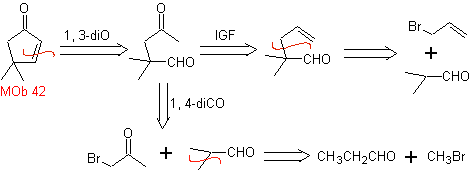
Synthese. Das Allylbromid alkyliert den Aldehyd, das Produkt wird oxidiert und dann in basischem Medium unter Bildung cyclisiert
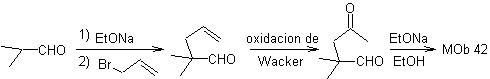
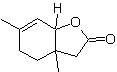
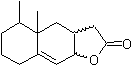
MOb 43, Retrosynthetische Analyse . Das Lacton, MOb 43, wird geöffnet, um eine γ-Hydroxysäure zu erzeugen, die durch IGFs zu einem 1,4-Ketoester gelangt, der gemäß dem Modell getrennt wird.
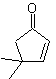
Cyclohexenon wird durch die Robinson-Anellierung gebildet und 1,5-diCO wird durch die Michael-Reaktion hergestellt.
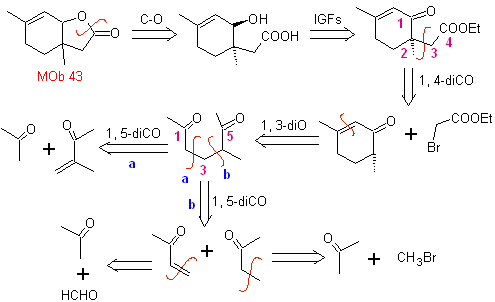
Synthese. Das sekundäre Kohlenstoff-Enamin wird unter Verwendung eines voluminösen sekundären Amins erhalten. Die 1,5-diCO-Verbindung wird durch Robinson-Anellierung cyclisiert und dann im basischen Medium mit dem α-Bromester umgesetzt. Die resultierende Diketonverbindung wird mit LiAlH 4 reduziert und dann wird in saurem Medium das Lacton MOb 43 gebildet.
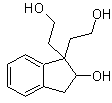
MB 44 . Retrosynthetische Analyse. Das erste IGF von
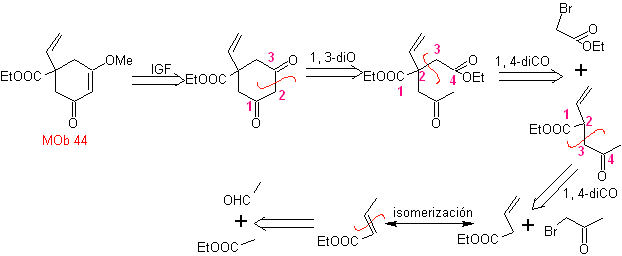
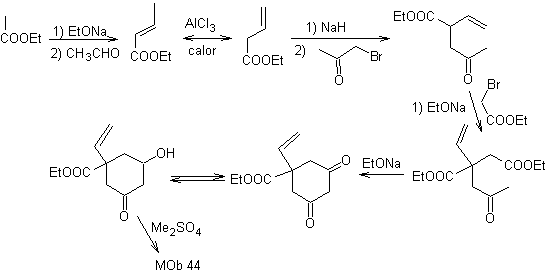
Synthese. Es ist eine Folge von Kondensationen vom Aldol- oder Claisen-Typ. Um zu synthetisieren
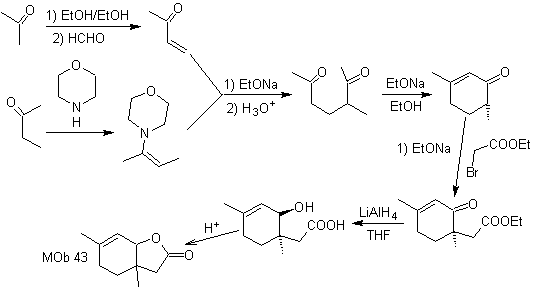
MB 45 . Retrosynthetische Analyse : Die Trennung der Lactonfunktion von
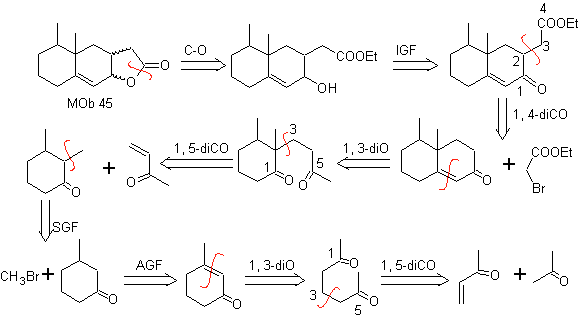
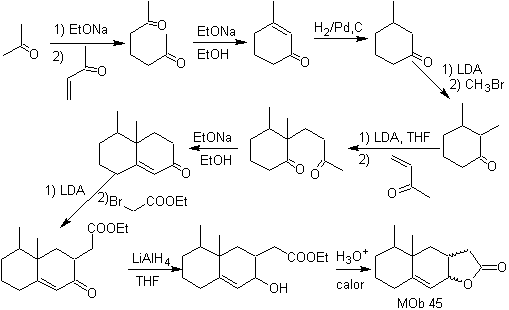
Synthese: Alle verwendeten Reaktionen sind mit der Michael-Kondensation, der Robinson-Anellierung und der Fischer-Esterbildungsreaktion verbunden, was es ermöglicht, das Lacton zu erhalten, das heißt
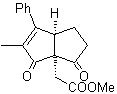
MOb 46. Retrosynthetische Analyse. . Es folgt die 1,4-diCO-Trennung, weil sie eine Aufspaltung in zwei Teile ermöglicht
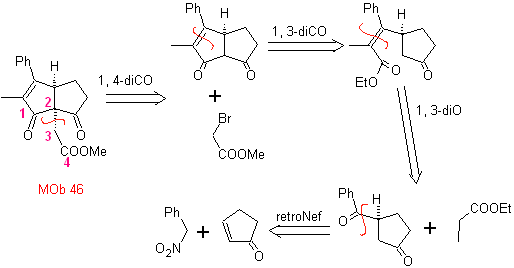
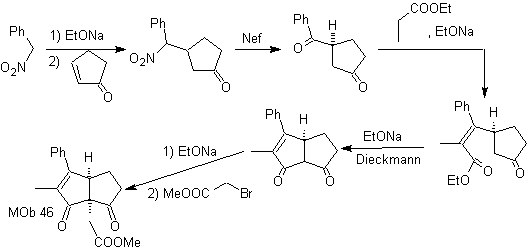
Synthese . Laut Michael addiert das Nitroaren-Nukleophil an α,β-ungesättigtes Cyclopentanon. Die Nitrogruppe wird durch die Nef-Reaktion in C=O umgewandelt. Die Dicarbonylverbindung wird mit dem Ethylpropanoatenolat umgesetzt, gefolgt von der Dieckmann-Reaktion,
und die dafür notwendigen Reaktionen
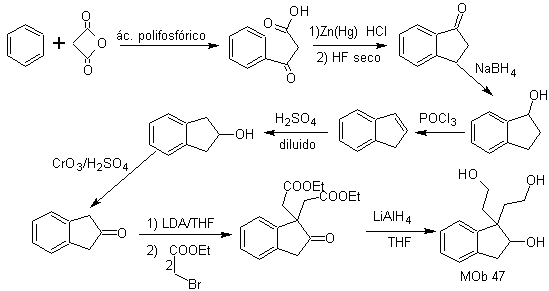
MOb 47. Retrosynthetische Analyse.
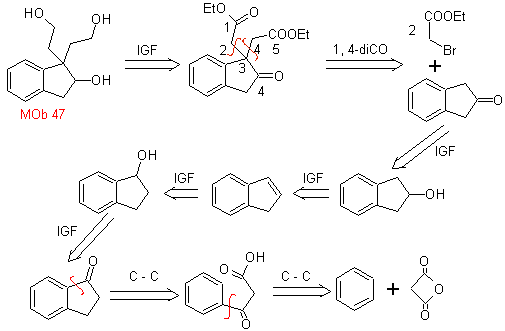
Synthese . Die Synthese von