ORGANISCHE SYNTHESE
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 25209
SYNTHESE VON HETEROZYKLEN DURCH INTRAMOLEKULARE ZYKLUSUNG
Der Aufbau von heterocyclischen Systemen verwendet ebenfalls diese gleichen Reaktionen, mit der Besonderheit, dass das heterocyclische System vorhanden sein muss oder mindestens ein anderes Atom als Kohlenstoff enthalten muss. Die häufigsten sind Stickstoff, Sauerstoff, Schwefel und Phosphor.
Das cyclische System des zu synthetisierenden Moleküls kann aus der Modifikation eines cyclischen Systems stammen, das in einem der an der Synthese beteiligten Reagenzien vorhanden ist, oder das Ergebnis der Cyclisierung nicht-cyclischer Vorläufer sein, die bei der Entwicklung der Synthese aufgebaut wurden durch intramolekulare Cyclisierung oder durch Methoden, die auf intermolekularen Cyclisierungen (Cycloadditionen) basieren.
1. Intramolekulare Cyclisierung
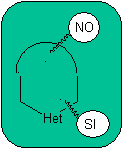
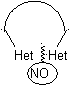
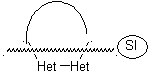
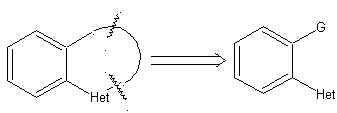
Die allgemeinen Regeln für die Trennung von Heterocyclen, die aus einer intramolekularen Cyclisierung stammen, wurden von JI Borrell angemessen systematisiert , die gleichen wie in diesem Abschnitt angenommen (Het = N, O, S)
1.
Bei der Synthese einer monocyclischen Verbindung beinhaltet der Ringschluss im Allgemeinen die Bildung einer Kohlenstoff-Heteroatom-Bindung.
Modell: |
|
Beispiel: |
|
|
|
Beispiel : |
|
Modell: |
|
Beispiel: |
|
Weiterlesen: Synthese von Heterocyclen durch intramolekulare Cyclisierung
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 21367
MB: 75 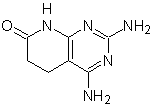 | MB: 76 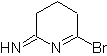 |
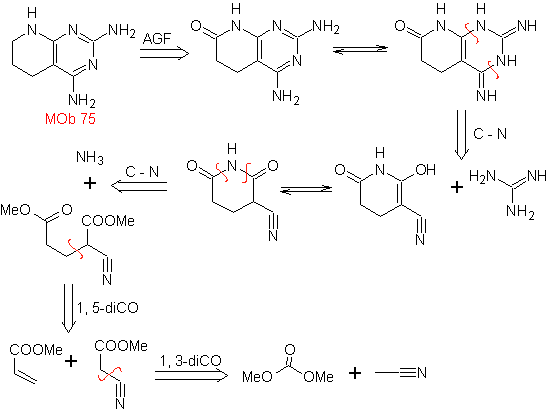
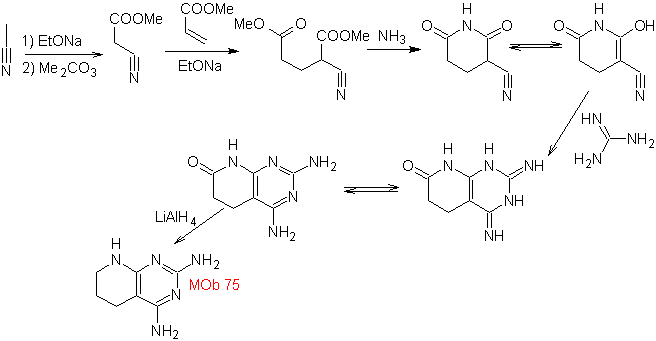
Weiterlesen: Die Cyanogruppe in der Synthese von Heterocyclen
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 26535
Synthese von Heterocyclen mit mehreren Heteroatomen
Heterocyclische Verbindungen haben, wie bereits erwähnt, ein breites Anwendungsspektrum: Sie überwiegen unter den Verbindungen, die als Pharmazeutika, Agrochemikalien und für die Veterinärmedizin verwendet werden; sie werden als Polierzusätze, Antioxidantien, Korrosionsinhibitoren, als Farbstoffe und Pigmente verwendet; und in vielen weiteren Anwendungen.
Daher ist es vernünftig, dass sich derzeit ein Großteil der Forschung in der Chemie mit der Synthese und den Eigenschaften von heterocyclischen Verbindungen befasst. Daran orientiert sich dieser Artikel, der Chemiestudenten grundlegende Retrosynthese-Werkzeuge an die Hand geben soll.
Der Trennungsprozess für Moleküle mit mehreren Heteroatomen kann für jede Kohlenstoff-Heteroatom-Bindung gemäß den zuvor untersuchten Modellen oder gleichzeitig durchgeführt werden, wofür erschwingliche Polyheteroatom-Reagenzien verwendet werden.
1. Abstand Heteroatome (1, 2)
Die repräsentativsten und gebräuchlichsten Reagenzien sind Hydrazine und substituierte Hydrazine sowie Hydroxylamine.
Hydrazin |
Hydroxylamin |
Schlagen Sie ein Synthesedesign aus einfachen Materialien für die folgenden Moleküle vor:
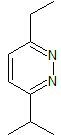
Mob 77
Pyrazole | MB 78
Isoxazole | MB 79
Pyridazine |
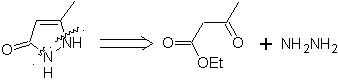
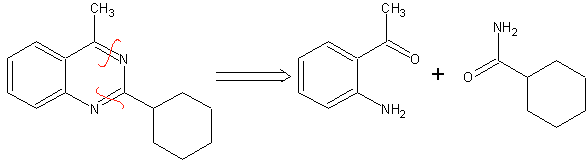
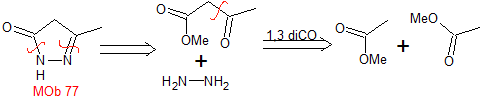
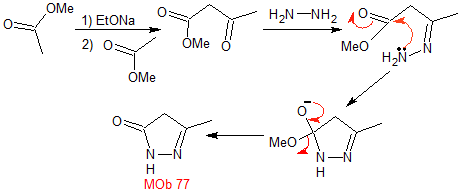
MOB 77 . Retrosynthetische Analyse. MOb ist ein Pyrazolderivat und wird direkt durch CN-Bindungen getrennt, um einfache Vorstufen wie Hydrazin und eine 1,3-diCO-Verbindung zu erzeugen.
|
Synthese . Methylacetat ist eine gute Vorstufe zur Bildung der Verbindung 1,3-diCO, die sich mit Hydrazin verbindet, um MOb 77 zu erzeugen. |
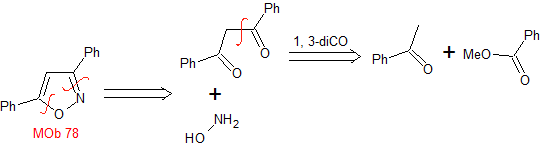
MOb 78 – Retrosynthetische Analyse .
|
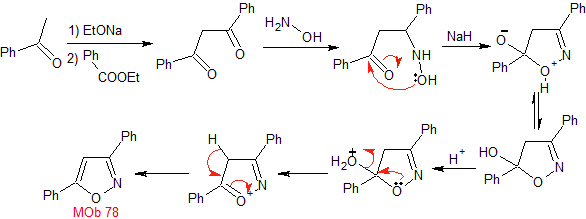
Synthese. Benzophenon und Ethylbenzoat ermöglichen es, das benötigte 1,3-diCO zu bilden, in leicht saurem Medium mit Hydroxylamin zu reagieren und nach Zugabe von NaH erfolgt eine Cyclisierung, die mehr Säure erfordert
dehydrieren und schließlich produzieren
|
Weiterlesen: Synthese von Heterocyclen mit mehreren Heteroatomen
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 20276
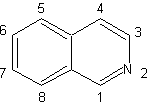
Isochinolin-Synthese
(Durch die Methode der Trennung)
| Isochinoline unterscheiden sich strukturell von Chinolinen in der Position Stickstoff, da dieser nicht kondensiert ist, also eine "aliphatische Reaktivität" aufweist. Es kommt in der Natur nicht frei vor, aber der Isochinolin-Zyklus findet sich in einigen Alkaloiden in aromatischer oder reduzierter Form, zB Papaverin. |
Die bekanntesten Syntheseverfahren zur Herstellung von Isochinolinen gehen von 2-Phenylethylaminen aus und beinhalten eine Cyclisierung durch ein zusätzliches Kohlenstoffatom, das von der Carbonylgruppe einer anderen Verbindung bereitgestellt wird.
Die wichtigsten Syntheseverfahren sind: die Pomeranz-Fritsch-Synthese, die Bischler-Napieralski-Synthese, die Pictet-Gams-Synthese und die Pictet-Spengler-Synthese.
1. Synthese von POMERANZ-FRITSCH.
Diese Synthesemethode von Isochinolin erfolgt in zwei Stufen:
Zu.
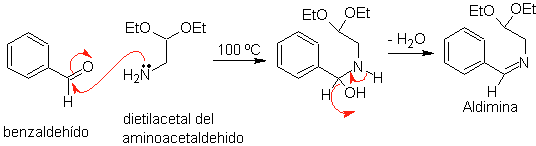
Zunächst wird Benzaldehyd (1,3-Elektrophil-Nukleophil) mit Aminoacetaldehyddiethylacetal (1,3-Nukleophil-Elektrophil) kondensiert, um ein stabiles Aldimin zu bilden.
B.
Anschließend cyclisiert das Aldimin in stark saurem Medium zu einem Imin unter gleichzeitiger Abspaltung von Ethanol zu einem Isochinolin.
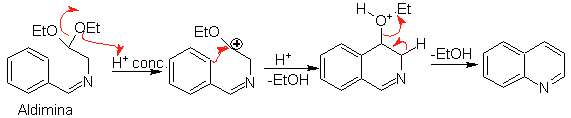
Diese zweite Stufe, die eine elektrophile Substitution ist, unterliegt der Wirkung, die die elektronenspendenden oder -aufnehmenden Substituenten am Benzolring in dieser Reaktion haben. Aufgrund der Hydrolyse des gebildeten Imins in dem bei der Reaktion verwendeten stark sauren Medium wird jedoch die Ausbeute des Verfahrens verringert.
Dieses Verfahren ermöglicht den Zugang zu C-1-substituierten Isochinolinen, für die aromatische Ketone getestet wurden, mit sehr geringen Ausbeuten. Größer war jedoch die Verwendung der Variante der entsprechend substituierten Benzylamine als 1,4-Dinukleophile und Glyoxaldiethylacetal als 1,2-Dielektrophile.
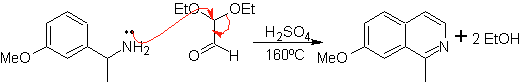
Etwas, das klargestellt werden muss, ist, dass das Pomeranz-Fritsch-Verfahren und seine zuvor analysierte Variante nicht die Herstellung von an C-3 und C-4 des Heteroatoms substituierten Isochinolinen erlauben. Die retrosynthetische Analyse dieses Verfahrens zeigt die möglichen Zwischenprodukte, die an der Reaktion beteiligt sind, und die wahrscheinlichen Ausgangsmaterialien.
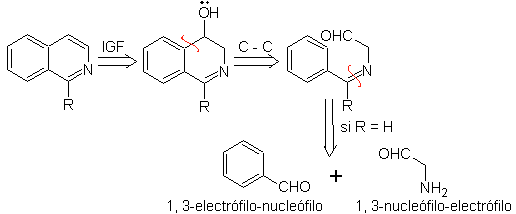
Schlagen Sie ein Synthesedesign für jedes der folgenden Isochinoline vor: | MB 107
| MB 108
|
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 16852
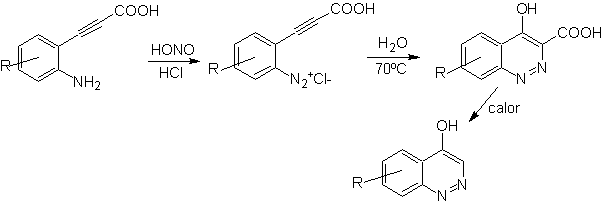
Synthese von BENZODIAZINEN
(Durch die Methode der Trennung)
Die Strukturen von Benzodiazinen finden sich in viele Alkaloide, hauptsächlich als Chinazolon-Ringsystem. Auch die anderen Derivate des Benzodiazins, wie Cinnoline, Chinoxaline und Phthalizine, sind ein wichtiger Bestandteil vieler Arzneistoffe mit einem bedeutenden Anwendungsspektrum, was ihnen im Allgemeinen eine große Bedeutung in der organischen Synthese und insbesondere in der Pharmakochemie verleiht. So finden sie sich als entzündungshemmend, blutdrucksenkend, antibakteriell, schmerzlindernd, antibiotisch usw.
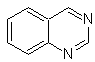
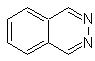
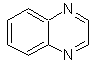
Cinnolin |
Chinazolin | |
Phthalizin |
Chinoxalin |
Synthese der Cinnoline
Entsprechend der Struktur, die Cinnolin aufweist, gibt es die folgenden Optionen für seine Synthese:
![]() von Richter-Synthese:
von Richter-Synthese:
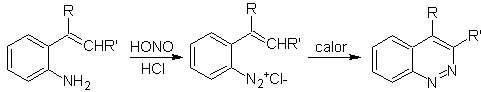
![]() Widman-Stoermer-Synthese:
Widman-Stoermer-Synthese:
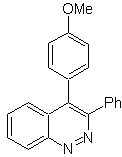
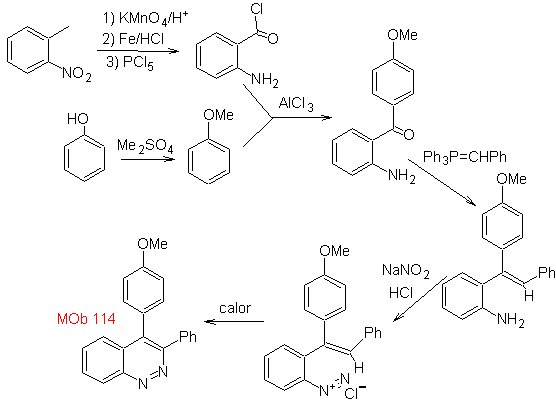
Schlagen Sie einen Syntheseplan für das folgende Molekül vor : | MB 114
|
MB 114 . Retrosynthetische Analyse.
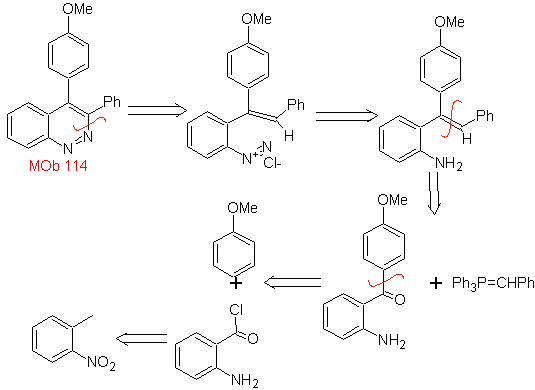
Synthese Die Bildung von
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 64030
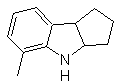
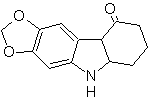
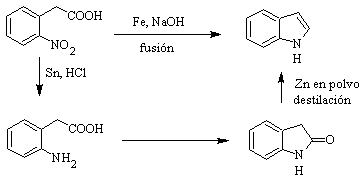
Synthese von INDOLES
(Durch die Methode der Trennung)
Das Indol-Ringsystem wurde in vielen natürlichen Verbindungen von großem chemischem und biochemischem Interesse gefunden, weshalb es als das am häufigsten vorkommende in der Natur gilt. So ist Tryptophan eine essentielle Aminosäure, Indigo ein Farbstoff und Indolyl-3-Essigsäure ein Pflanzenwachstumshormon. Andererseits ergibt sich das Interesse an diesen Molekülen aus ihrer pharmakologischen Verwendung, Beispiele sind Sumatriptan (Antimigräne) und Frovatriptan, ebenfalls ein Antimigränemittel.
Indol ist ein farbloser kristalliner Feststoff mit einem Schmelzpunkt von 52 °C, der in den meisten organischen Lösungsmitteln leicht löslich ist und aus Wasser kristallisiert, einen angenehmen Geruch hat und daher auch als Parfümbasis verwendet wird.
Es wurde erstmals 1866 durch Erhitzen von Oxindol mit Zinkstaub hergestellt und ist zu einem wichtigen Handelsprodukt geworden. Baeyer schlug 1869 die folgende Synthese vor:
Die klassischen Synthesemethoden für Indole sind die von Fischer, Bischler, Reissert u Leimgruber-Batcho, Bartoli, Larock, Gassman, Sugasawa, Fukuyama, Hegedus und Dobbs.
1.
FISCHER-Synthese
Es besteht aus dem Erhitzen von Phenylhydrazonen von Ketonen oder Aldehyden mit wasserfreiem Zinkchlorid, Bortrifluorid, Polyphosphorsäure oder einem anderen Säurekatalysator, um Indole herzustellen. Unter Abspaltung von Wasser und NH 3 erfolgt eine säurekatalysierte Umlagerung eines Phenylhydrazons. Elektronendonorgruppen begünstigen die Cyclisierung und Elektroattraktoren behindern sie.
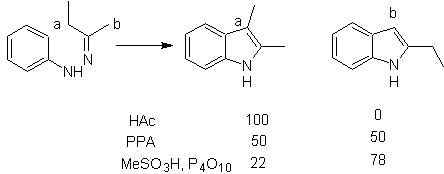
Bei asymmetrischen Ketonen kann die intramolekulare Cyclisierung des Hydrazons je nach den verwendeten Bedingungen zu zwei isomeren Indolen in unterschiedlichen Anteilen führen, wobei in stark sauren Medien das weniger substituierte Indol überwiegen kann.
Wenn meta-Substituenten in Bezug auf den Hydrazon-Stickstoff vorhanden sind, kann die Cyclisierung in zwei Positionen stattfinden, was zu zwei isomeren Indolen führt:
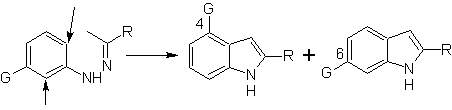
Wenn der Substituent G elektroabziehend ist, werden die beiden Isomere (4- und 6-) in ungefähr gleichen Anteilen gebildet. Wenn G andererseits ein elektronenspendender Substituent ist, wird hauptsächlich das 6-substituierte Isomer gebildet.Die retrosynthetische Analyse des durch die Fischer-Synthese gebildeten Indols kann wie folgt betrachtet werden:
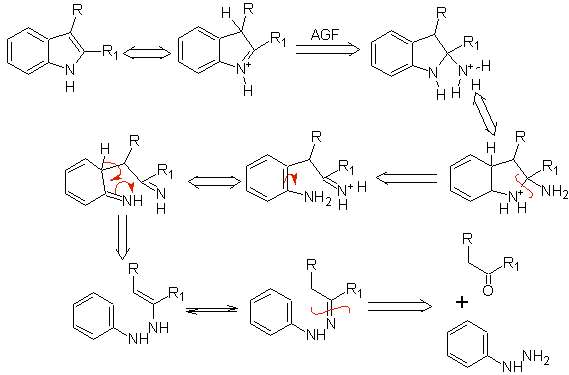
Schlagen Sie einen Syntheseplan für die folgenden Moleküle vor: | MB 119
| MB 120
|
MOb 119. Retrosynthetische Analyse. Die grundsätzliche Trennung in den Indolen, die durch die Fischer-Synthese gebildet werden sollen, entspricht einer Retro-Transposition, die sich in der Trennung von zeigt
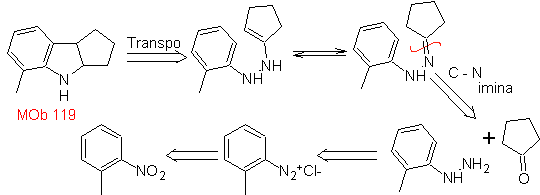
Synthese : Aus ortho-Nitrotoluol wird das Zwischenderivat von Phenylhydrazin erzeugt, das bei der Synthese von Fischer-Indolen notwendig ist, das Imin wird mit einem Cyclopentanon und durch Erhitzen gebildet
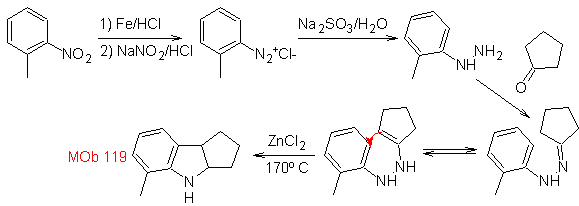
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 21254
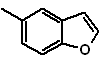
Synthese von
Benzofurane und Benzothiophene
(Durch die Methode der Trennung)
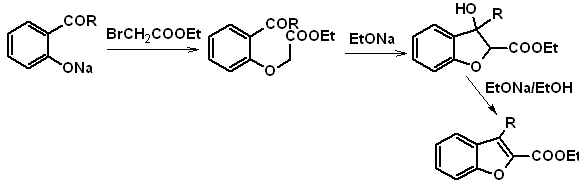
1. Synthese von Benzofuranen
Benzofuran, üblicherweise Cumaron genannt, Es ist eine farblose Flüssigkeit, die aus Kohlenteer isoliert wird und gegenüber chemischem Angriff wesentlich stabiler ist als Furan.
Die klassischsten Synthesen zur Herstellung von Benzofuranen werden genannt und entwickelt:
Zu. Aus dem Cumarin
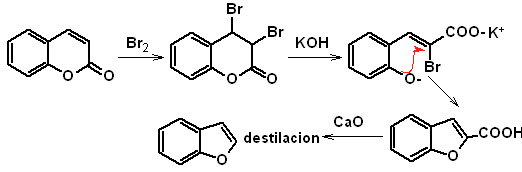
B. Aus einer internen Claisen-Kondensationsreaktion
C.
Beginnend einer Claisen-Umlagerung
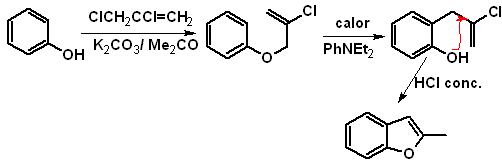
Schlagen Sie ein Synthesedesign für die folgenden Benzofurane vor:
: | MB 127
| … | MB 128
|
MOb 127, Retrosynthetische Analyse. Die Disengagement-Strategie, in
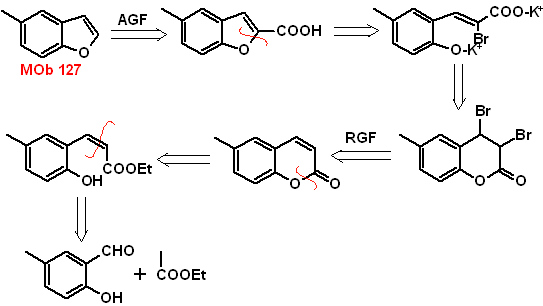
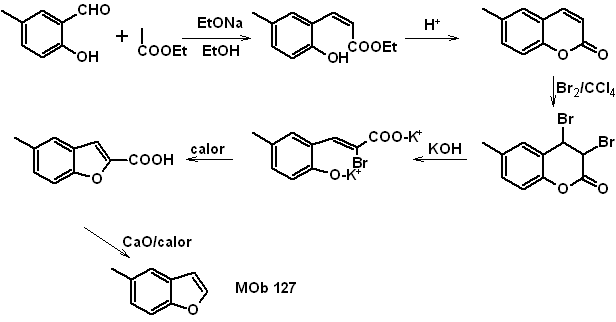
Synthese. Das Zwischenprodukt 2-Hydroxy-5-methylbenzaldehyd wird aus Benzol hergestellt. Das gebildete Cumarinderivat wird halogeniert, in einem KOH-Sol hydrolysiert und anschließend mit CaO erhitzt, um es zu decarboxylieren und so zu bilden
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 47178
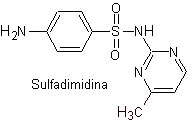
SULFAMID-SYNTHESE
Es ist bekannt, dass Sulfonamide die ersten antimikrobiellen Mittel waren, die systemisch verwendet wurden. Seine chemische Struktur ist ein Benzolkern mit Aminogruppen, die ihm seine Aktivität verleihen. Die Aminogruppe wird in der Leber acetyliert und dadurch inaktiviert. Abhängig vom Substituenten in diesem Sektor ist das Medikament aktiver.
Aufgrund seiner Ähnlichkeit mit para-Aminobenzoesäure verhält es sich wie ein kompetitiver Inhibitor dieser Substanz, die zusammen mit Dihydropteridin zur Synthese von Dihydrofolsäure, einer Zwischenverbindung im Folatsyntheseweg, notwendig ist.
Im Gegensatz zu fortgeschritteneren Organismen müssen Bakterien ihre eigenen Folate synthetisieren [sie beziehen sie nicht aus der Umwelt], daher hemmen Sulfonamide, indem sie diesen Prozess hemmen, die Prozesse der Synthese von Nukleinsäuren und sind BAKTERIOSTATISCH.
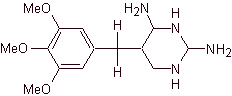
TRIMETROPRIM
Trimethoprim ist ein Derivat von 2,4-Diaminopyrimidinen wie z | Diese Verbindung hemmt das Enzym Dihydrofolat-Reduktase und verhindert die Bildung von Tetrahydrofolsäure, dh sie wirken auf dem gleichen Stoffwechselweg wie Sulfonamide, jedoch in einer nachfolgenden enzymatischen Reaktion. Trimethoprim wird niemals allein verwendet, aber in Verbindung mit Sulfonamiden werden sie so potenziert, dass sie BAKTERIZID werden, die Möglichkeit der Resistenzbildung verringern und das antimikrobielle Spektrum erhöhen. Die Assoziation zwischen Sulfamethoxazol und Trimethoprim ist festgelegt: 1:5. Aus diesem Grund kommen beispielsweise die Handelspräparate Cotrimoxazole [forte or not]. |
Sulfonamide, Sie werden im Allgemeinen nach der Dauer ihrer Wirkung und der Art der Anwendung des Arzneimittels sowie anderen Merkmalen klassifiziert. Je nach Wirkungsweise können Sulfonamide sein:
Zu)
Kurz oder mittelfristig wirkende Sulfonamide.
Zu. Allgemein verwendbare Sulfonamide
Jo. Sulfathiazol
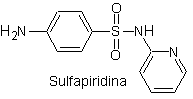
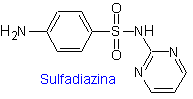
ii. Sulfadiazin
iii. Sulfadimidin
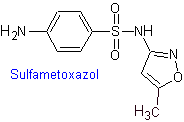
iv. Sulfamethoxazol (allein oder in Verbindung mit Trimethoprim: Cotrimoxazol)
B. Hochlösliche Verbindungen, die ursprünglich zur Behandlung von Harnwegsinfektionen eingesetzt wurden.
Jo. Sulfisoxazol
ii. Sulfamethizol
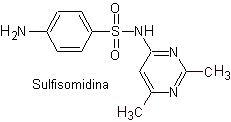
iii. Sulfasomidine
B)
Lang wirkende Sulfonamide.
iv. Sulfamethoxypyridazin
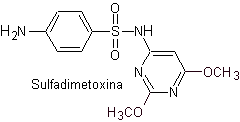
v. Sulfadimethoxin
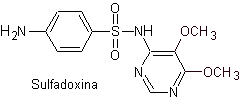
gesehen. Sulfadoxin
C)
Sulfonamide sind auf den Magen-Darm-Trakt beschränkt
vii. Sulfaguanidin
VIII. Sulfatalidin
ix. Sulfasuxidin
X. Sulfazolazin
D) Topische Sulfonamide.
xi. Mafenidacetat
xiii. Silbersulfadiazin
xiii. Sul Facetamid Natrium
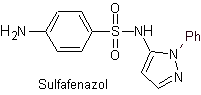
Wichtigste Sulfaten:
| ……… |
|
|
|
| …….. |
|
|
|
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 24985
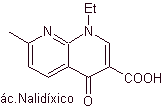
Synthese von Fluorchinolon-Antibiotika
Chinolone gehören zu einer Gruppe synthetischer antibakterieller Wirkstoffe. Das älteste Mittel dieser Familie, Nalidixinsäure, das in den frühen 1960er Jahren verwendet wurde, hat ein gutes Spektrum gegen Enterobakterien (begrenztes antibakterielles Spektrum), aber seine Pharmakokinetik ist aufgrund seiner geringen Bioverfügbarkeit in Geweben und seiner kurzen Hälfte für den routinemäßigen klinischen Einsatz nicht sehr günstig -Leben.
Aus diesem Grund war es notwendig, neue Antibiotika dieser Familie zu synthetisieren, um das Wirkungsspektrum und das pharmakokinetische Profil zu verbessern, Nebenwirkungen und das Auftreten von Bakterienresistenzen zu reduzieren. Diese neue Gruppe sind die sogenannten Fluorchinolone, die in den 80er Jahren entwickelt wurden.
|
Viele Forscher sind sich einig, dass die Gould-Jacobs-Reaktion , die Hauptgrundlage für die Synthese der ersten Chinolone für die pharmakologische Verwendung ist, die in den 1960er Jahren stattfand, weist diese Reaktion die folgende Sequenz auf:
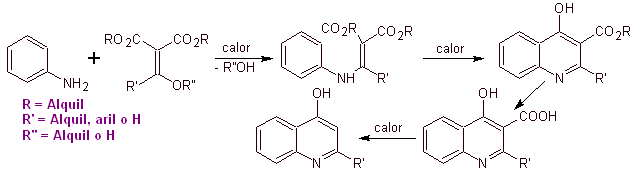
In den folgenden Jahren wurden Fluor in Position 6 und verschiedene Gruppen von Heterocyclen in Position 7 in den Basisring von Benzochinolonen eingeführt, wodurch Fluorchinolone mit einem größeren antibakteriellen Spektrum entstanden.
Wichtige Teile der in diesen Synthesen verwendeten Methoden wurden von Leyva S und Leyva E zusammengestellt in sehr guter Arbeit aus biochemischer Sicht.
Die auf den Bericht der untersuchten Synthesen angewendete Trennungsmethode und die Reaktionen der ersten Stufen der Synthesen liegen in der alleinigen Verantwortung des Autors dieser Monographie. .
i) Synthese berichtet von Koga H. et al.
Retrosynthetische Analyse:
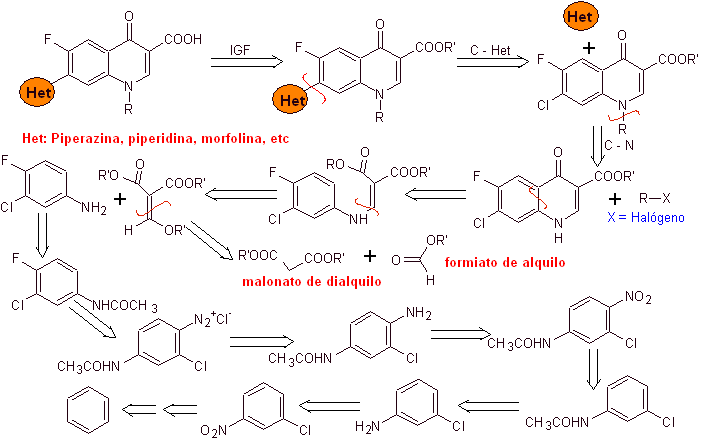
Synthese: Es bildet ausgehend von Benzol 3-Chlor-4-fluoranilin, das mit Diethyl-EMME zum entsprechenden Acrylat reagiert, das beim Erhitzen eine zyklische Verbindung bildet. Diese Verbindung wird wiederum mit einem Alkylierungsmittel umgesetzt und anschließend wird die stickstoffhaltige heterocyclische Verbindung eingeführt, um schließlich zu hydrolysieren und das Zielmolekül zu erhalten.
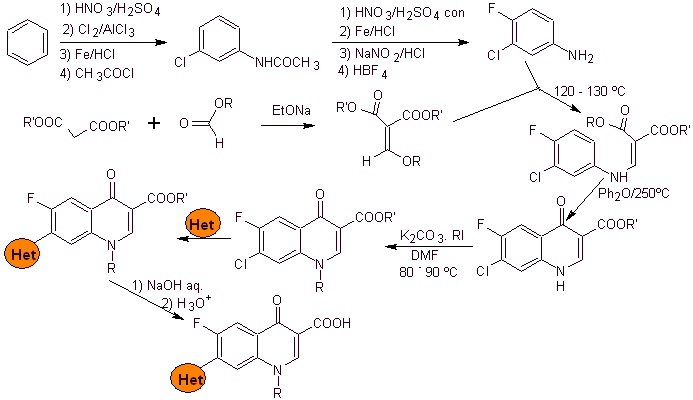
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 37285
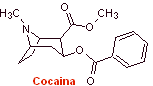
Synthese von Lokalanästhetika aus Benzoesäure
Die Eigenschaften der aus den Blättern der Kokapflanze isolierten Alkaloide wurden erstmals 1855 von Gaediche entdeckt, die Reinigung und Isolierung des Wirkstoffs namens Kokain durch Albert Nieman 1860 begann praktisch die Geschichte der Lokalanästhetika. . Anschließend führte Einhorn 1904 Procain (Novocain) als Lokalanästhetikum in der Medizin ein. |
|
Seitdem erlebt die Menschheit eine kontinuierliche und nachhaltige Entwicklung der Synthese neuer Moleküle mit anästhetischen Wirkstoffen:
![]() 1925 synthetisierte Niescher Nupercain.
1925 synthetisierte Niescher Nupercain.
![]() 1928 stellte Von Eisleb Tetracain (Pantocain) u
1928 stellte Von Eisleb Tetracain (Pantocain) u
![]() 1946 synthetisierten Lofgren und Lundquist Lognicain (Xylocain oder Lidocain).
1946 synthetisierten Lofgren und Lundquist Lognicain (Xylocain oder Lidocain).
![]() Dann erhielten Af Ekenstam und Egner 1954 die Synthese von Mepivacain (Scandicain).
Dann erhielten Af Ekenstam und Egner 1954 die Synthese von Mepivacain (Scandicain).
![]() Später in den Jahren 1960 und 1964 wurden sie eingeführt
Später in den Jahren 1960 und 1964 wurden sie eingeführt
![]() Schließlich wurden in den folgenden Jahren neue Anästhetika in die Medizin aufgenommen.
Schließlich wurden in den folgenden Jahren neue Anästhetika in die Medizin aufgenommen.
Lokalanästhetika sind Medikamente, die bei Anwendung auf einen bestimmten Körperbereich einen vorübergehenden und reversiblen Empfindlichkeitsverlust (thermisch, schmerzhaft und taktil) hervorrufen, ohne das Bewusstsein des Patienten zu beeinträchtigen. Die Dauer der Wirkung des Arzneimittels hängt von der verwendeten Dosis, seiner chemischen Struktur, der Formulierung und der Darreichungsform des Arzneimittels ab.
Im Allgemeinen sprechen Lokalanästhetika auf unterschiedliche chemische Strukturen an, aber alle haben ähnliche Wirkungen oder unterschiedliche Intensitäten der anästhetischen Wirkung. Es kann jedoch versucht werden, sie in Benzoesäureester, Aminobenzoesäureester, Amide usw. einzuteilen.
1 . Chemische Struktur von Lokalanästhetika
Lokalanästhetika sind überwiegend schwache Basen und werden von einer Arengruppe gebildet, Ester oder Amid, die dem Molekül lipophile Eigenschaften verleihen (die hauptsächlich die Wirksamkeit des Arzneimittels bestimmen), eine aliphatische tertiäre Aminogruppe (Alkyl oder Alicyclus), die dem Molekül seinen hydrophilen Charakter verleiht, und eine Alkyl-Zwischenkette, die die Teile verbindet das Aren mit dem Amin und ist für die Toxizität verantwortlich des Medikaments.
Somit lassen sich die wichtigsten Lokalanästhetika, die in den verschiedenen medizinischen Disziplinen verwendet werden, in die folgenden Gruppen einteilen:
Zu)
Aminoester der Benzoesäure :
B)
Ester der m-Aminobenzoesäure :
C)
Ester der p-Aminobenzoesäure :
D) Amide:
Und)
Ketone :
F)
andere Gruppen
2 . Synthese von Lokalanästhetika aus Benzoesäureaminoestern
Die repräsentativsten Drogen dieser Gruppe sind Kokain, Hexylcain, Piperocain, Ethylaminobenzoat, Meprilcain, Amylocain, Cyclomethicain und Propanocain. Diese Namen reagieren auf
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 38196
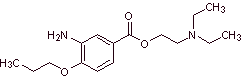
Synthese von Lokalanästhetika aus Aminobenzoesäure
Aus m-Aminobenzoesäure gewonnene Lokalanästhetika
Die repräsentativsten Medikamente dieser Gruppe sind
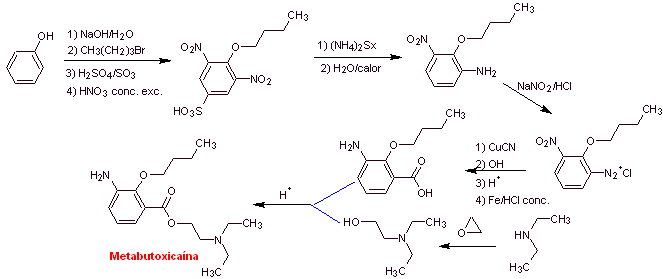
MOb 07: Metabutoxycain , vermarktet unter dem Namen Primacain , ist ein weiteres Lokalanästhetikum, das in der Zahnheilkunde verwendet wird. Schlagen Sie ein Synthesedesign für dieses Medikament vor, ausgehend von einfachen und erschwinglichen Materialien. |
|
Retrosynthetische Analyse : Acyl-Sauerstoff-Spaltung erzeugt einen Aminoalkohol, der zu sekundärem Amin und Epoxid spaltbar ist; der andere Vorläufer lädt dazu ein, seine Carboxylgruppe durch Hydrolyse einer Nitrilgruppe herzustellen, die durch die Sandmeyer- Reaktion an den Benzolring platziert wird. Die selektive Reduktion nur einer der Nitrogruppen erfolgt mit Ammoniumpolysulfid oder auch mit Na 2 S.
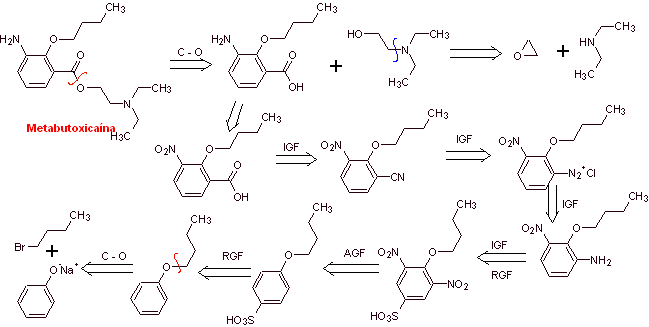
Synthese von
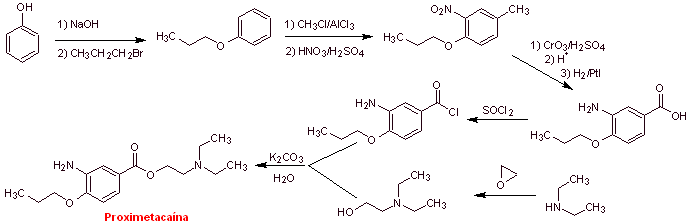
MOb 08: Proximethacain (INN) oder Proparacain , bekannt unter den Handelsnamen Alcaine, Ak-Taine und anderen, ist ein Lokalanästhetikum aus der Gruppe der Aminoester. Es ist zur Verwendung als Augenanästhetikum indiziert, um Schmerzen und Beschwerden im Auge zu lindern. Schlagen Sie ein Synthesedesign für dieses Anästhetikum vor, ausgehend von einfachen und erschwinglichen Materialien. |
|
Retrosynthetische Analyse : Die anfängliche Acyl-Sauerstoff-Trennung von Proxymethacain führt wiederum zu einer m-Aminobenzoesäure mit einem Alkoxid-Substituenten in der para-Position und einem Aminoalkohol, der aus dem entsprechenden Amin und Epoxid gebildet wird.
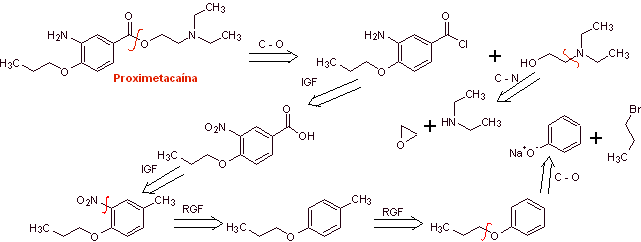
Synthese von Proximethacain :
Weiterlesen: Synthese von Lokalanästhetika aus Aminobenzoesäure
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 29827
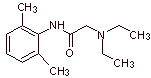
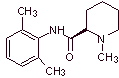
Synthese von Lokalanästhetika aus Phenylacetamiden
Eine Liste der Hauptbestandteile dieser Gruppe von Anästhetika wird vorgestellt nächste:
Lidocain (Lignocain, Xylocain), Mepivacain, Etidocain, Articain (Carticain), Bupivacain, Prilocain, Dibucain (Cincocain), Ropivacain, Trimecain, Butanylicain, Clibucain, Tolicain, Trimecain, Vadocain oder Xitazain, Anidicain, Dimethisoquin, Oxetazin, Pyrrocain, Paramoxin, Properacain, Oxetacain.
MOb 19 ; |
|
Retrosynthetische Analyse :
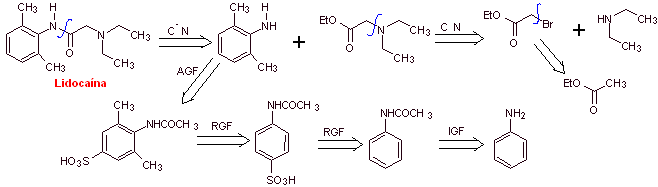
Synthese von
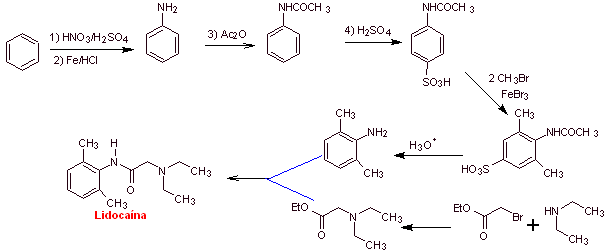
MOb 20: Mepivacain ist ein Lokalanästhetikum vom Amidtyp, es wirkt schneller als Procain, aber seine anästhetische Wirkung ist kürzer als die von Procain. Wie die meisten Anästhetika wird es als Racemat-Hydrochloridsalz geliefert. |
|
Retrosynthetische Analyse : Die anfängliche Trennung durch die Amidbindung erzeugt zwei Vorläufermoleküle, von denen eines, 2,6-Dimethylanilin, bereits synthetisiert wurde
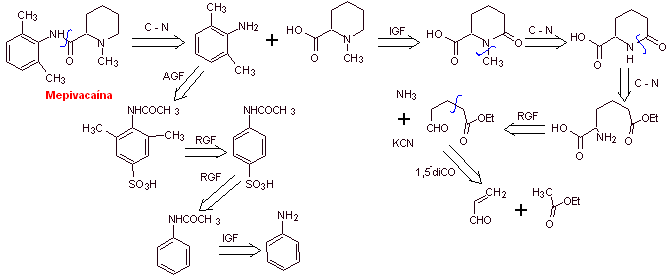
Synthese von Mepivacain :
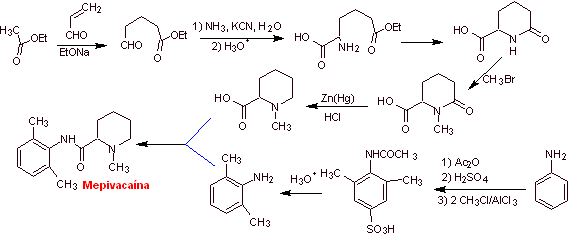
Weiterlesen: Synthese von Lokalanästhetika aus Phenylacetamiden
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 18602
Synthese von Lokalanästhetika aus verschiedenen Funktionsgruppen
Es gibt Analgetika, die, da sie von anderen funktionellen Gruppen als Benzoesäure, Aminobenzoesäure oder Phenylacetamid abgeleitet sind, auch ähnliche analgetische Eigenschaften wie zuvor synthetisierte Arzneimittel aufweisen. Die repräsentativsten in dieser Gruppe sind die folgenden:
Phenacain, Promocain (Pramoxin), Bucricain, Ethylchlorid, Dimethisoquin, Diperodon , Ketocain, Myrtecain, Octacain, Dyclonin (Dilocain)
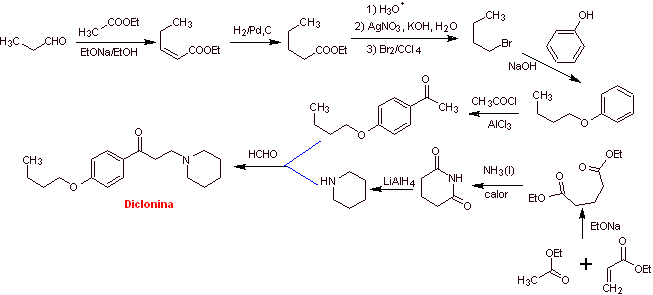
MOb 29 : Dyclonine ist ein orales Anästhetikum in Sucrets, einem weiteren der Halspastillen. Es ist auch in einigen Sorten von Cepacol-Spray gegen Halsschmerzen enthalten. Schlagen Sie die Synthese des Arzneimittels vor. |  |
Retrosynthetische Analyse : Die Struktur von Ketoamin ermöglicht es uns, eine Trennung vorzuschlagen, die mit der Mannich-Reaktion (Methylketon + Formaldehyd + sekundäres Amin) verbunden ist. Nachfolgende Trennungen der Vorläufermoleküle sind mit relativ einfachen chemischen Reaktionen mit hoher Ausbeute verbunden.
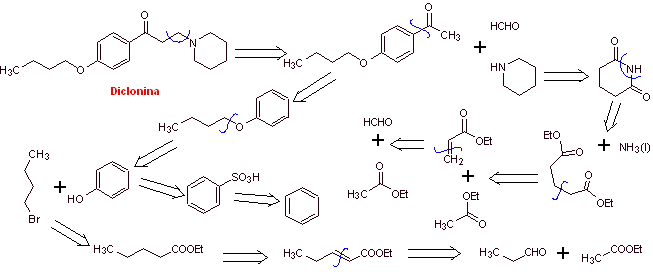
Synthese von Dyclonin :
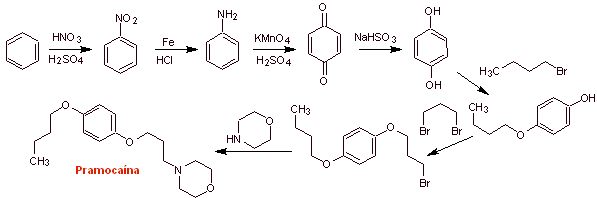
MOb 30 : Pramocain ( auch als Pramoxin bekannt) ist ein topisches Anästhetikum, das als Antipruritikum verwendet wird. Sein Hydrochlorid ist wasserlöslich und wird daher leichter von der Haut aufgenommen. Schlagen Sie ein Synthesedesign für dieses Molekül aus einfachen und erschwinglichen Materialien vor. |
|
Retrosynthetische Analyse :
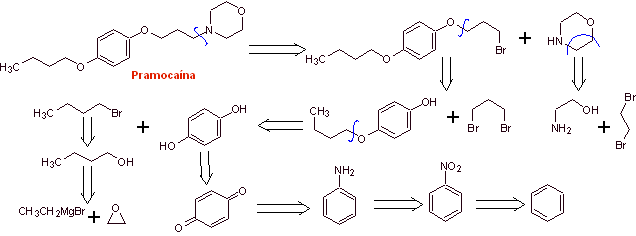
Pramocain-Synthese :
Weiterlesen: Synthese von Lokalanästhetika aus verschiedenen funktionellen Gruppen
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 13553
Polyaspartat-Synthese (rootGrow)
1. Polyaspartat-Synthese (rootGrow)
Es wird behauptet, dass die rootGROW-Formel mit der von Nutra-Sweet (Aspartam) verwandt ist, einem starken Süßstoff, der aufgrund seiner schädlichen Auswirkungen auf die Gesundheit vom Markt genommen wird oder bereits vom Markt genommen wurde.
Nutra-sweet kann nach folgendem Schema aus Phenylalanin synthetisiert werden:
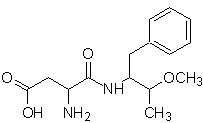
Nutra süß
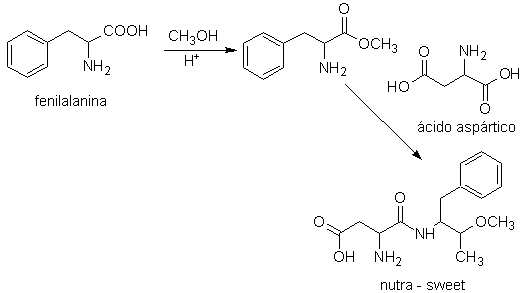
Die Asparaginsäure, die grundlegende Base, um das rootGrow zu erhalten, das rechtsdrehend (D) oder linksdrehend (L) sein kann, wird wiederum gemäß den folgenden Syntheseschemata hergestellt:
Schema A: (Transaminierungsprozess)
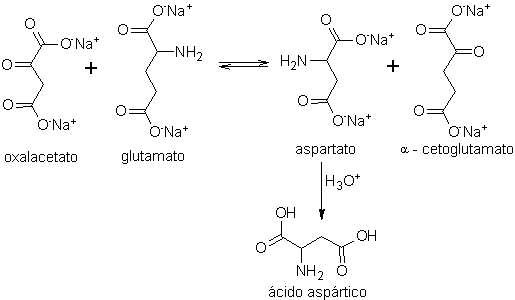
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 26430
Synthese von 1,3- und 1,5-Dicarbonylverbindungen
Schlagen Sie ein Synthesedesign nach der Trennungsmethode (Synthon-Methode) aus einfachen und erschwinglichen Materialien für die folgenden Moleküle vor:
(Denken Sie daran, dass, wenn es nicht möglich ist, eine direkte Trennung vorzuschlagen, auf die Strategie der vorherigen Funktionalisierung des MOb zurückgegriffen werden muss, bis ein anwendbares Trennungsmodell erreicht ist.)
LÖSUNGEN FÜR VORGESCHLAGENE PROBLEME
MOb 01 hat kein Sauerstoffverhältnis, ein Aspekt, der für den Chemiker in gewisser Weise von Vorteil ist. Das heißt, die zu verwendende Strategie ermöglicht die Suche nach dioxygenierten Beziehungen im Vorläufermolekül (synthetisches Äquivalent) mit einem gewissen Freiheitsgrad, d. h. es kann je nach Struktur des MOb eine Reihe von Dicarbonylgruppen postuliert werden und/oder Hydroxycarbonylbeziehungen, in relativen Positionen 1,2, 1,3 , 1,4, 1,5 und/oder 1,6 oder ihre Varianten, wie α,β-ungesättigte Carbonylverbindungen.
Bei dieser Gelegenheit wird die Synthese durchgeführt, wobei auf die dioxygenierten Verhältnisse von 1,3 und/oder 1,5 zurückgegriffen wird. Auf diese Weise werden das Zielmolekül und die Vorläufer gemäß einem bekannten und vorher festgelegten Muster in trennbare Strukturen umgewandelt.
Lösung MOb 01
Retrosynthetische Analyse : Bei dem betreffenden Molekül kann man damit beginnen Führen Sie eine AGF durch, indem Sie eine C=O-Gruppe in der Struktur des Vorläufermoleküls an einer solchen Position platzieren, die es später ermöglicht, eine weitere AGF mit einer Doppelbindung am Alpha- und Beta-Kohlenstoff in Bezug auf das Carbonyl herzustellen, um fortzufahren um es zu trennen.
Die α,β-Unsättigung in Bezug auf C=O muss als das am stärksten substituierte Alken der möglichen Alternativen gesucht werden. Das Vorhandensein eines Substituenten in der Beta-Position an C=O lässt uns vermuten, dass er gemäß der konjugierten Michael-Additionsreaktion als Nucleophil an eine α,β-ungesättigte Carbonylverbindung addiert sein könnte. Aufgrund dieser Überlegungen kann für MOb 01 folgende retrosynthetische Analyse postuliert werden:
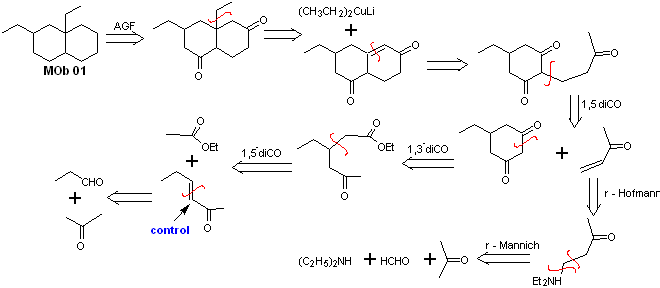
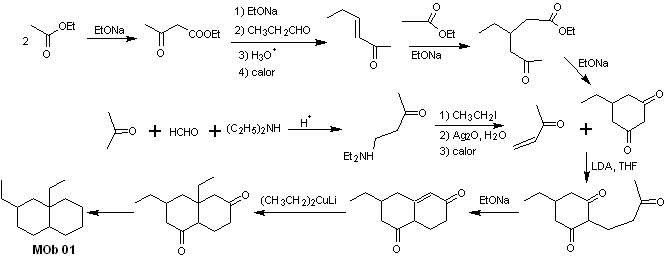
Synthese von MOb 01 : Die Kondensation zwischen einem enolisierbaren Aldehyd und Keton erzeugt normalerweise Selbstkondensations- oder Kreuzkondensationsprodukte. Dies kann vermieden werden, indem auf die Strategie der Kontrollausübung im Nucleophil des zurückgegriffen wird Keton, wie aus dem beigefügten Schema ersichtlich ist.
Wenn es andererseits erforderlich ist, Vinylketone als Substrat in der Michael-Reaktion zu verwenden, würde dies die Verwendung von Formaldehyd bedeuten. Leider neigt dieser in basischem Medium sehr reaktive Aldehyd zu Polymerisationsreaktionen, die die Ausbeute der Synthese drastisch mindern, weshalb für Vinylketone mit hohen Ausbeuten die Mannich-Reaktion und die Hofmann-Eliminierung adäquat kombiniert werden.
Die Hofmann-Eliminierung könnte im gleichen basischen Medium durchgeführt werden, das für die Michael-Reaktion verwendet wird, so dass es nicht notwendig ist, das Vinylketon zu isolieren.
Aufgrund der noch begrenzten Erfahrung in der Synthese wird jedoch die Verwendung von Silberoxid in einem wässrigen Medium postuliert, um die Eliminierung des Amins und die Bildung des Vinylketons zu erreichen.
Weiterlesen: Synthese von 1,3- und 1,5-Dicarbonylverbindungen
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 42976
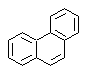
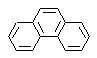
Phenanthren-Synthese
(Synthesebaum-Methode)
Phenanthren ist ein polyzyklischer aromatischer Kohlenwasserstoff, der drei kondensierte Benzolringe enthält, weshalb es ein Isomer von Anthracen ist.
| entweder |
|
Die traditionellen Syntheseverfahren von Phenanthren, die die Bildung von Zyklen und deren anschließende "Aromatisierung" beinhalten, sind mit den von Haworth und Bardhan-Sengupta (1932) vorgeschlagenen verbunden, wie unten zu sehen sein wird.
Es ist auch möglich, andere neue Methoden für Phenanthren und allgemein für polycyclische aromatische Verbindungen vorzuschlagen, basierend auf der entsprechenden Verwendung der Ullman-Kupplungsreaktionen, der Heck-Reaktion, der Suzuki-Reaktion und der MacMurry-Reaktion, sowie der Varianten und Erweiterungen, die diese Reaktionen darstellen.
Zu) Haworths Synthese:
Dieses Verfahren basiert auf der Friedel-Crafts-Acylierungsreaktion und hat den Nachteil, dass die abschließende Cyclisierung zum Bilden des dritten an Naphthalin ankondensierten Rings nicht selektiv ist, da es auch möglich ist, dass der Verschluss in dem anderen Kohlenstoff neben der Gruppe stattfindet, die es enthält die Carboxylfunktion und bildet somit ein Isomer, das sich aufgrund der Reaktionsbedingungen als in der Minderzahl herausstellt.
Methode A :
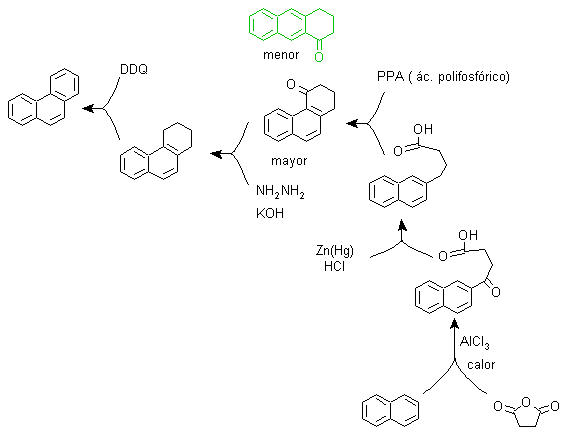
Die Ausgangsmaterialien sind üblicherweise Naphthalin und Bernsteinsäureanhydrid. Um sicherzustellen, dass die Acylierungsreaktion mit dem Anhydrid am Kohlenstoff 2 (beta) von Naphthalin stattfindet, muss die Reaktion bei einer Temperatur von über 60 °C durchgeführt werden.
Bei Raumtemperatur ist die Acylierungsposition Kohlenstoff 1 (Alpha), was zu einer Variante des Verfahrens führt, die jedoch im Wesentlichen die gleichen Reaktionen sind, die auftreten, und es gibt auch die Bildung eines anderen Isomers, das viel weniger signifikant ist als im ersten Fall. Daher wird es vorzugsweise als offizielle Reaktion zur Herstellung von Phenanthren nach der Howorth-Methode verwendet.
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 31851
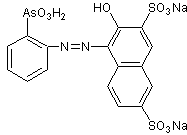
THORIN-SYNTHESE
Die analytischen Anwendungen von Thorin, die Arbeitsparameter, seine Grenzen und Perspektiven werden in spezialisierten Veröffentlichungen zur chemischen Analyse wie Analytical Chemistry ausreichend detailliert behandelt und erläutert. Eine kurze Zusammenfassung davon zeigt die folgenden Anwendungen:
In saurem Medium : Es dient zur quantitativen Bestimmung der Elemente Thorium (Th), Zirkonium (Zr), Fluor (F), Hafnium (Hf) und Uran (U).
In basischem Medium : Die Disulfonsäureform von Thorin, besser bekannt als Thoron, wird zur quantitativen Bestimmung von Lithium (Li) verwendet.
In neutralem Medium : Thorin dient als Indikator für die Bestimmung von Sulfationen (SO 4 2- ) in wässrigen Lösungen.
Thorin wird auch zur Bestimmung von SO 2 in Luft verwendet.
Forschungsproblem.
Angesichts der Nachfrage nach diesem Reagenz für verschiedene analytische Bestimmungen und insbesondere für die kolorimetrische Analyse von Lithium in Solen aus dem Gran Salar de Uyuni und des geringen Angebots davon auf dem nationalen Markt entsteht die Notwendigkeit, Thorin aus einfachen Materialien zu synthetisieren und erschwinglich in unserer Umwelt.
Zu diesem Zweck werden die entworfenen Synthesewege aus dem RETROSYNTHESIS-Paradigma angegangen , wobei die Methoden von The Synthesis Sheets, die Disconnection or Synthon Method und die Tree Method anwendbar sind. der Synthese.
In Bezug auf die Synthese von Thorin gibt es eine kurze und zusammenfassende Beschreibung der Synthese von Thoron in der Literatur , entsprechend der vorgeschlagenen Richtung von Kuznetsov , das heißt, es wird angegeben, dass es für die Herstellung von Thoron erforderlich ist, dass die o-Aminophenylarsonsäure mit dem Dinatriumsalz von 2-Naptol-3,6-disulfonsäure (Salz R) in an saures Medium.
Synthesedesign für die Thorina .
Das Design wird durch die Methode der Trennung oder Sintón angegangen, die zwei Phasen in Betracht zieht. Der erste bezieht sich auf die retrosynthetische Analyse und der zweite auf die Synthese in Richtung des Laborgeschehens, dh von den Ausgangsmaterialien bis zum Erreichen des Zielmoleküls (MOb).
Zu) Artikel Struktur und Reaktivität zu berücksichtigen, für die retrosynthetische Analyse
Thorin ist typischerweise eine Azoverbindung, also ein Farbstoff. Die Herstellung dieser Verbindungen umfasst im Allgemeinen zwei grundlegende Reaktionen, nämlich: Diazoierung und Diazokupplung (oder einfach Kupplung).
Andererseits haben alle Kupplungsvorläufermoleküle, die zur Bildung von Azofarbstoffen verwendet werden, einen gemeinsamen Charakter, nämlich: ein aktives Wasserstoffatom, das mit einem Kohlenstoffatom verbunden ist.
Als Vorläufermoleküle (Substrate) für die Kopplung werden häufig verwendet: Verbindungen mit phenolischen Hydroxylgruppen, wie Phenole und Naphthole, aromatische Amine, Moleküle mit enolisierbaren aliphatischen Ketongruppen und heterocyclische Moleküle, wie Pyrrol, Indol usw. .
In Bezug auf die Kopulationsreaktion müssen bestimmte heuristische Prinzipien berücksichtigt werden, nämlich:
· Phenole kuppeln leichter als Amine und Mitglieder der Naphthalinreihe leichter als Benzol.
· Substituenten mit negativer induktiver Wirkung (-I), wie Halogene, Nitro-, Sulfa-, Carboxyl- und Carbonylgruppen, verzögern die Kupplung.
· Eine Alkyl- oder Alkoxygruppe in ortho- oder meta- Position bezüglich einer Aminogruppe fördert die Kopplung. Und wenn sie bezüglich der Aminogruppe in Position 2 und 5 stehen, sind sie besonders gute Kuppler.
· In der Benzolreihe erfolgt die Kupplung gewöhnlich in para- Stellung in Bezug auf die Hydroxyl- (-OH) oder Amino- (-NH 2 )-Gruppe. Wenn die Position für besetzt ist, erfolgt die Verknüpfung an der Ortho-Position.
· In der Naphthalinreihe wird, wenn sich die Aminohydroxylgruppe an Position 2 ( b ) befindet, der Reaktant an Position 1 ( a ) gekuppelt . Befindet sich die Hydroxyl- oder Aminogruppe in alpha-Stellung, erfolgt die Bindung üblicherweise an der 4-Stellung; aber wenn Position 3 oder 6 durch eine Sulfonsäuregruppe besetzt ist, findet die Vereinigung in der Beta-Position statt.
· Wenn es zwei mögliche Kupplungspositionen gibt, wird die Position der Bindung häufig durch den pH-Wert des Mediums bestimmt: Die Kupplung erfolgt in ortho- Stellung zur Aminogruppe, wenn sie in einem sauren Medium durchgeführt wird, und in ortho- Stellung zur Hydroxylgruppe, wenn sie durchgeführt wird es wird in einem basischen Medium durchgeführt.
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 57530
SYNTHESE VON BENZODIAZEPINEN (BDZ)
Von. Wilbert Rivera Munoz
Diese E-Mail-Adresse ist vor Spambots geschützt! Zur Anzeige muss JavaScript eingeschaltet sein!
Diese Substanzen erzeugen eine große Vielfalt