Isochinolin-Synthese
(Durch die Methode der Trennung)
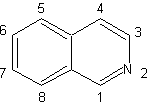
| Isochinoline unterscheiden sich strukturell von Chinolinen in der Position Stickstoff, da dieser nicht kondensiert ist, also eine "aliphatische Reaktivität" aufweist. Es kommt in der Natur nicht frei vor, aber der Isochinolin-Zyklus findet sich in einigen Alkaloiden in aromatischer oder reduzierter Form, zB Papaverin. |
Die bekanntesten Syntheseverfahren zur Herstellung von Isochinolinen gehen von 2-Phenylethylaminen aus und beinhalten eine Cyclisierung durch ein zusätzliches Kohlenstoffatom, das von der Carbonylgruppe einer anderen Verbindung bereitgestellt wird.
Die wichtigsten Syntheseverfahren sind: die Pomeranz-Fritsch-Synthese, die Bischler-Napieralski-Synthese, die Pictet-Gams-Synthese und die Pictet-Spengler-Synthese.
1. Synthese von POMERANZ-FRITSCH.
Diese Synthesemethode von Isochinolin erfolgt in zwei Stufen:
Zu.
Zunächst wird Benzaldehyd (1,3-Elektrophil-Nukleophil) mit Aminoacetaldehyddiethylacetal (1,3-Nukleophil-Elektrophil) kondensiert, um ein stabiles Aldimin zu bilden.
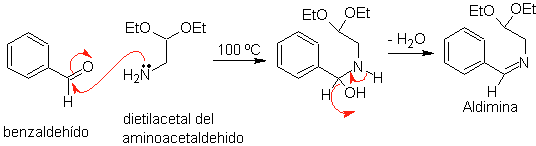
B.
Anschließend cyclisiert das Aldimin in stark saurem Medium zu einem Imin unter gleichzeitiger Abspaltung von Ethanol zu einem Isochinolin.
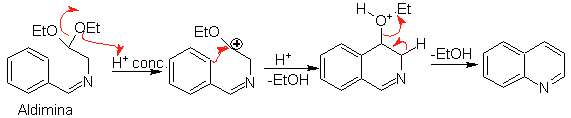
Diese zweite Stufe, die eine elektrophile Substitution ist, unterliegt der Wirkung, die die elektronenspendenden oder -aufnehmenden Substituenten am Benzolring in dieser Reaktion haben. Aufgrund der Hydrolyse des gebildeten Imins in dem bei der Reaktion verwendeten stark sauren Medium wird jedoch die Ausbeute des Verfahrens verringert.
Dieses Verfahren ermöglicht den Zugang zu C-1-substituierten Isochinolinen, für die aromatische Ketone getestet wurden, mit sehr geringen Ausbeuten. Größer war jedoch die Verwendung der Variante der entsprechend substituierten Benzylamine als 1,4-Dinukleophile und Glyoxaldiethylacetal als 1,2-Dielektrophile.
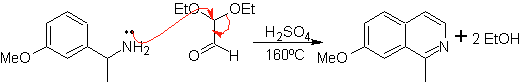
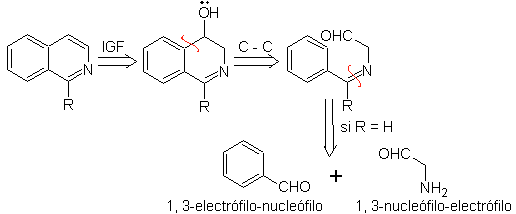
Etwas, das klargestellt werden muss, ist, dass das Pomeranz-Fritsch-Verfahren und seine zuvor analysierte Variante nicht die Herstellung von an C-3 und C-4 des Heteroatoms substituierten Isochinolinen erlauben. Die retrosynthetische Analyse dieses Verfahrens zeigt die möglichen Zwischenprodukte, die an der Reaktion beteiligt sind, und die wahrscheinlichen Ausgangsmaterialien.
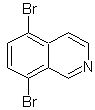
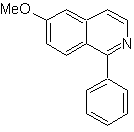
Schlagen Sie ein Synthesedesign für jedes der folgenden Isochinoline vor: | MB 107
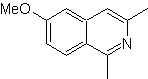
| MB 108
|
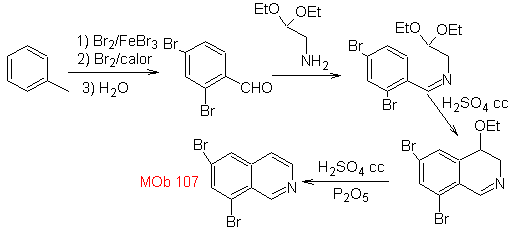
MB 107 . Retrosynthetische Analyse . Die Trennung von
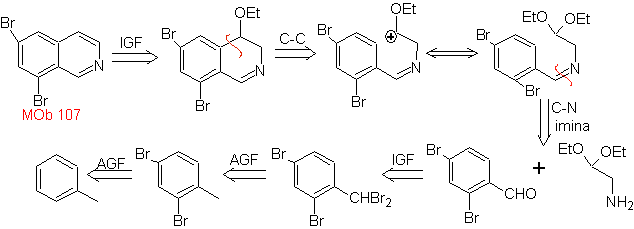
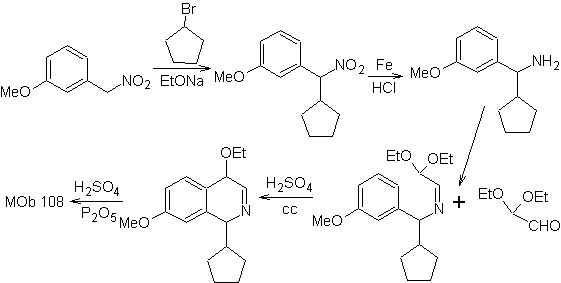
MOb 108. Retrosynthetische Analyse . Das Vorhandensein eines Substituenten an C1 von Isochinolin, führt zum Trennen
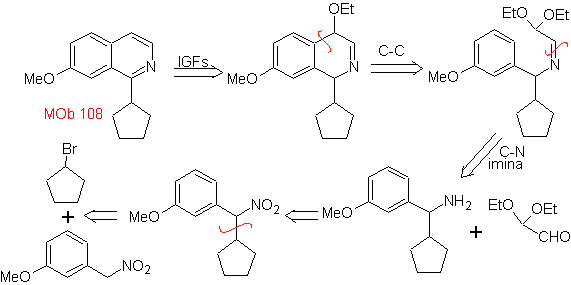
Synthese Das Benzyalminderivat wird hergestellt, um es mit dem Aminoaldehyddiacetal gemäß der Pomeranz-Fritsch-Synthese zu reagieren, um es zu bilden
2. BISCHLER-NAPIERALSKI-Synthese .
Dieses Syntheseverfahren von Isochinolinen beinhaltet die Umsetzung eines Phenethylamins (1,5-Dinukleophil) mit einem Säurechlorid oder -anhydrid (Elektrophil) zu einem Amid, dessen Cyclisierung unter Wasserverlust zu einem 2,4-Dihydroisochinolin mit einem Substituenten führt C-1, das mit Pd-C oder Phenyldisulfid zu Isochinolin oxidiert wird.
Der Cyclisierungsschritt ist eine elektrophile aromatische Substitution und wird daher durch elektronenspendende Substituenten am aromatischen Ring von Phenethylamin begünstigt. Die m-substituierten Phenethylamine führen durch Cyclisierung in para-Stellung zur aktivierenden Gruppe ausschließlich zu C-6-substituierten Isochinolinen.
Die retrosynthetische Analyse der nach diesem Verfahren hergestellten Isochinoline ist wie folgt:
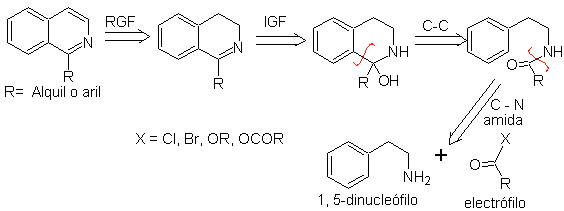
Die bei dieser Synthese am häufigsten verwendeten Cyclisierungsmittel sind:
Zu.
P 2 O 5 (Phosphorpentoxid)
B.
POCl 3 (Phosphoroxychlorid) und
C.
SOCl 2 (Thionylchlorid)
Schlagen Sie einen Syntheseplan für die folgenden Isochinoline vor: | MB 109
| MB 110
|
MB 109 . Retrosynthetische Analyse .
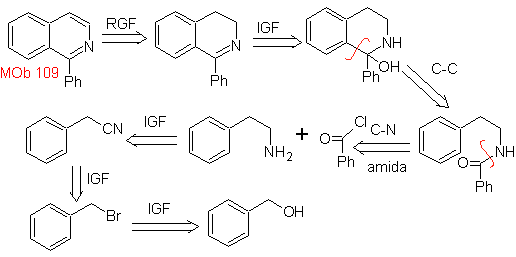
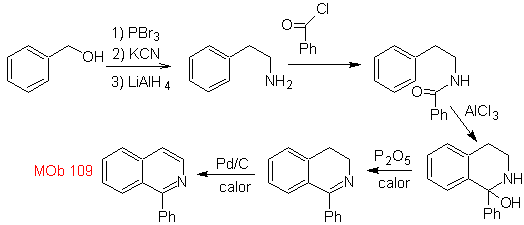
Synthese. Benzylalkohol ist ein guter Ausgangsstoff zur Bildung von Phenethylamin, das mit Benzoylchlorid kombiniert wird. Das Produkt wird cyclisiert und mit Pd/C und Hitze aromatisiert, um es zu bilden
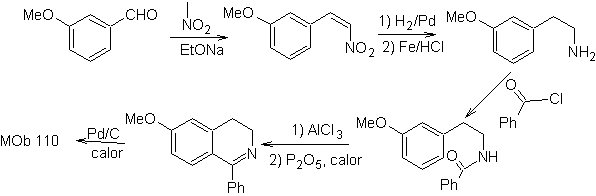
MOb 110. Retrosynthetische Analyse.
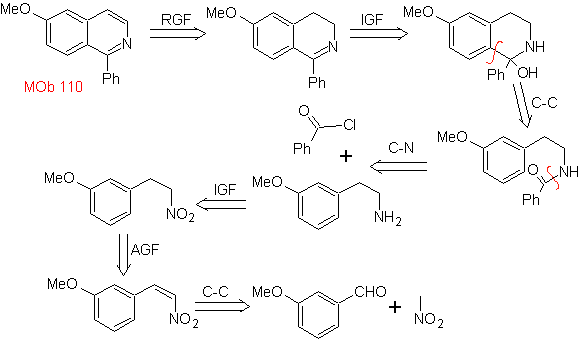
Synthese. Die Synthese von
3.
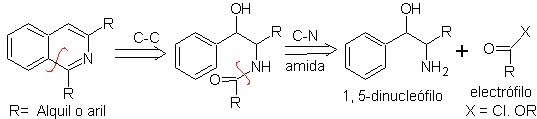
PICTET-GAMS-Synthese.
Es ist eine Variante der Bischler-Napieralski-Synthese, bei dieser Methode werden potentiell ungesättigte Phenethylamine verwendet, wodurch ein vollständig aromatischer Heterocyclus erhalten wird, daher ist die Anwendung von Oxidationsmitteln nicht erforderlich.
Die retrosynthetische Analyse dieses Verfahrens zeigt die folgenden potentiellen Wiederverbindungen und Ausgangsmaterialien.
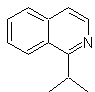
Schlagen Sie ein Synthesedesign für das folgende Isochinolin vor : | MB 111.
|
MB 111 . Retrosynthetische Analyse . Um die Trennung einzuleiten
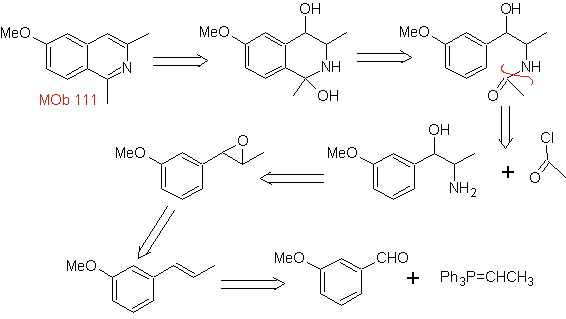
Synthese . Die Pictet-Gams-Synthese wird angewendet, sodass es nicht notwendig ist, am Ende ein Oxidationsmittel zu verwenden, um die Bildung von zu erreichen
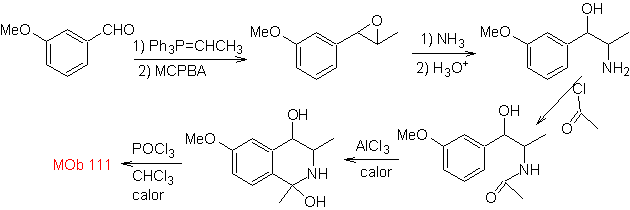
Phenethylamine können auch mit guten Ausbeuten mit Aldehyden reagieren, was Aldimine ergibt, die in einem sauren Medium zu 1,2,3,4-Tetrahydroisochinolinen cyclisieren können, die oxidiert werden müssen, um Isochinoline zu erzeugen.
Diese Cyclisierung erfordert geeignet platzierte aktivierende Substituenten zur Aktivierung der ortho-Stellungen zur Aminoethylgruppe, weshalb der Ringschluss immer in para-Stellung zum Aktivator erfolgt.
Wenn der aromatische Ring mit Hydroxylsubstituenten aktiviert wird, erfolgt der Ringschluss aufgrund der stark aktivierenden Wirkung von OH- unter sehr milden Bedingungen.
Retrosynthetische Analyse eines nach der Pictet-Spengler-Methode gebildeten Isochinolins , zeigt folgende Trennungen und Ausgangsstoffe:
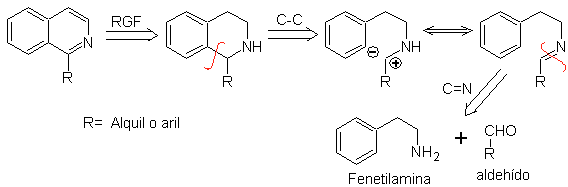
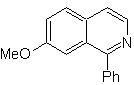
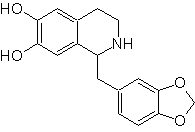
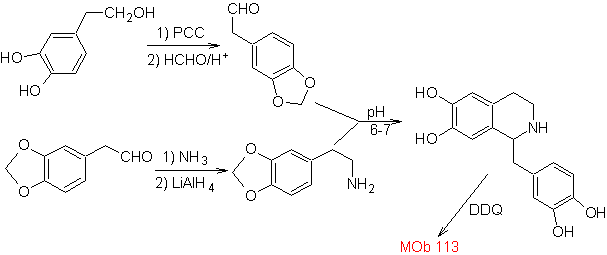
Schlagen Sie einen Syntheseplan für die folgenden Isochinoline vor: | MB 112
| ….. | MB 113
|
MOb 112. Retrosynthetische Analyse .
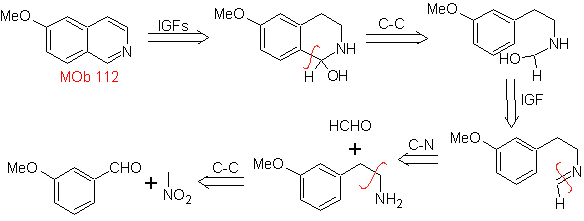
Synthese . Die Cyclisierung findet in einem sauren Medium statt und DDG wird zur Aromatisierung des gebildeten Hydroisochinolins zur Herstellung verwendet
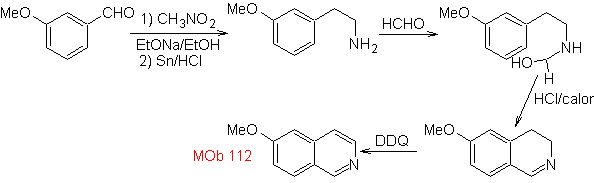
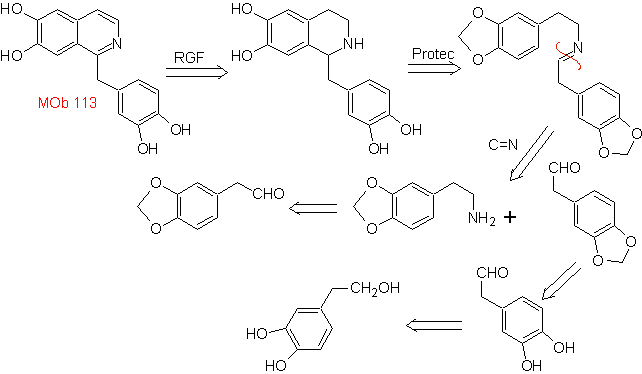
Synthese Die Pictet-Spengler-Synthese wird auf die Form angewendet
Amé Pictet (1857-1937) war eines von sechs Mitgliedern der Schweizer Vertretung und fungierte als Sekretär des Genfer Chemischen Kongresses . Als Vertreter von