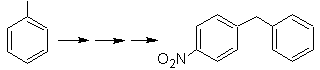SYNTHESE VON AROMATISCHEN VERBINDUNGEN II
(Synthesebaum-Methode)
Obwohl eines der ersten zu lösenden Probleme bei der Synthese mehrfach substituierter Aromaten die Kontrolle der Orientierungseffekte und die Bildung unerwünschter Isomere ist, ist es auch wichtig, die Reaktivität der Arene zu untersuchen, da irgendwann in der In Anbetracht des Vorhandenseins aliphatischer Gruppen in der aromatischen Verbindung weisen sie häufig Eigenschaften und Reaktivitäten auf, die typisch für die Art der organischen Verbindung sind, zu der sie gehören, und die besonderen, die sich aus der gegenseitigen Wechselwirkung der aliphatischen und aromatischen Gruppen ergeben.
Auf diesem Zweck basiert es, die Synthese der Moleküle Nr. 20 bis 27, Diesmal aus bestimmten Materialien, daher stellt sich die Frage wie folgt: Welche Reaktionen gibt es? Begründen Sie die folgenden Umformungen?
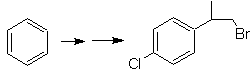
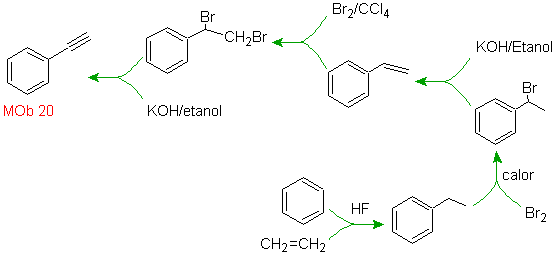
Mob20-Lösung.
Wir wissen, dass es daher keine Möglichkeit gibt, dass das Acetylidion direkt auf Benzol einwirkt die Dreifachbindung wird von einer Alkylgruppe erhalten
vec-dibromiert, das durch Bromierung von Styrol erhalten wird, das zuvor durch Dehydrobromierung erhalten wurde eines Benzylhalogenids, das durch eine Bromierung nach dem Radikalmechanismus an Ethylbenzol gebildet wird
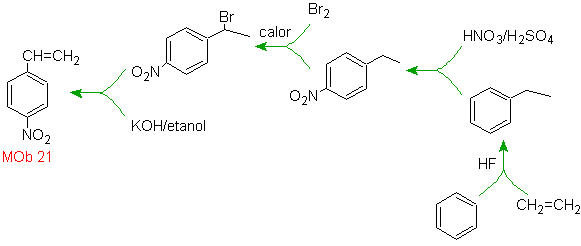
Lösung Mob 21.
Das para-Nitrostyrol kann nicht durch direkte Nitrierung von Styrol erhalten werden, da die an den Ring gebundene Ethenylgruppe unter Nitrierungsbedingungen instabil ist.
Als solches wird das Vorläufermolekül eine Gruppe aufweisen, die leicht zu dehydrobromieren ist. Diese Vorstufe wird durch radikalische Bromierung der an den Benzolring gebundenen Ethylgruppe erhalten, die zuvor hauptsächlich in para-Stellung nitriert wurde.
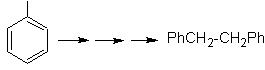
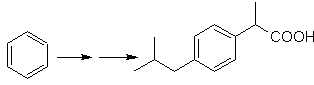
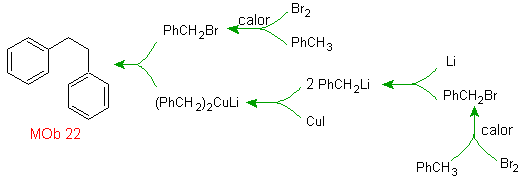
Lösung MOb 22.
Die Symmetrie des Moleküls erlaubt es uns, an eine Strategie zu denken, die die Corey-House-Reaktion berücksichtigt. Es ist auch eine gute Route, wenn Sie die verwenden
PhCH 2 CH 2 Cl, über die Benzol oder eine Acylierung mit PhCH2COCl und anschließende Reduktion der Carbonylgruppe durch Clemmensen-Reduktion berücksichtigt.
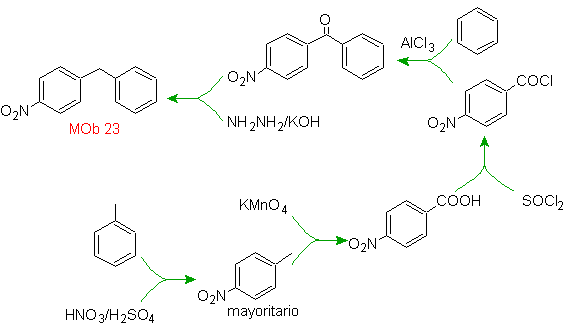
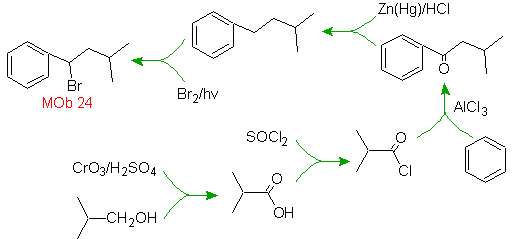
Mob-Lösung 23.
Das Vorläufermolekül kann ein Keton sein, dessen Carbonylgruppe durch das Wolf-Kischner-Reduktionsmittel zu Methylen reduziert wird. Auf diese Weise wird das Vorhandensein von Zn in einem sauren Medium, das die Nitrogruppe angreifen würde, vermieden. Ein weiteres Vorläufermolekül kann das folgende Halogenid sein: O 2 N-PhCH 2 Cl, das auf ein Benzolmolekül einwirkt.
Die Bromposition im Vorläufermolekül ist die typische allylische Position, die durch radikalische Bromierung des entsprechenden Kohlenstoffgerüsts erhalten wird.
Die Alkylgruppe am Benzolring kann nicht erhalten werden entsprechendes Halogenid, da eine Transposition auftreten würde. Dann erfolgt eine Acylierung und anschließende Reduktion der Carbonylgruppe mit Zinkamalgamierung in saurem Medium (Clemmensen-Reduktion).
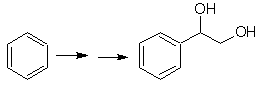
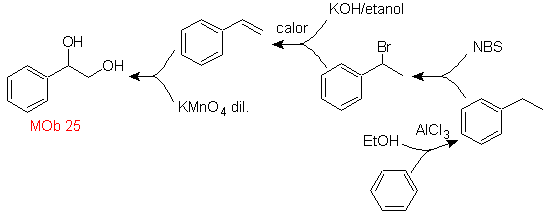
MOb 25-Lösung.
Das Diol dieses Moleküls kann durch eine selektive Hydroxylierung von Styrol, wie z
Vorläufermolekül. Styrol wird wie in früheren Fällen durch Dehydrobromierung gebildet.
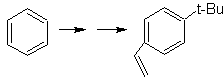
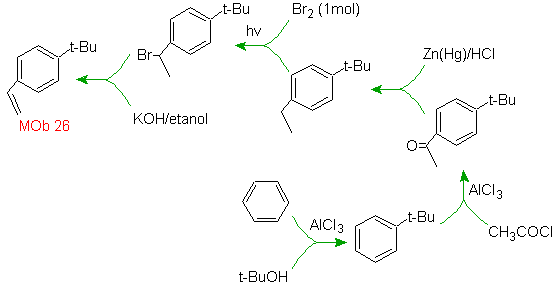
Lösung MOb 26.
Das Vorläufermolekül zeigt, dass ein möglicher Weg die Bildung der Ethenylgruppe aus einem Halogenid berücksichtigt und die voluminöse Gruppe von t-Butyl ausnutzt, um die Acylgruppe einzuführen, die die Ethylgruppe in para-Position trägt.
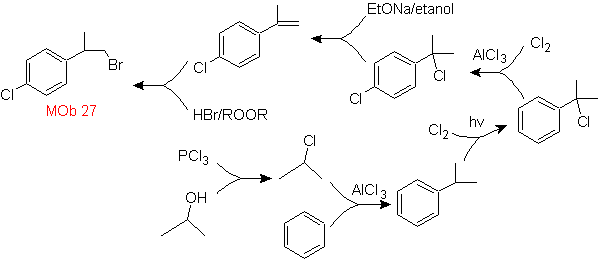
Mob-Lösung 27.
Die Strategie beinhaltet die Definition des Einschlusses von Bromid in ein Vorläufermolekül, das die Bildung eines Isomers nicht zulässt. Das am wenigsten substituierte Alken ist dasjenige, das notwendigerweise durch eine Dehydrohalogenierung aus einer durch Halogenierung von Radikalen gebildeten Gruppe gebildet wird.
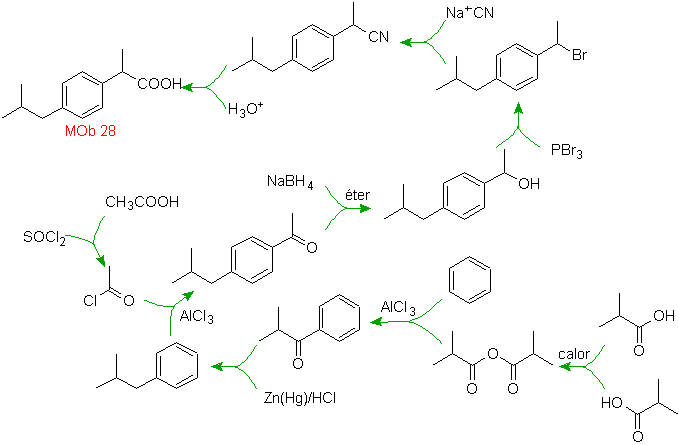
Lösung MOb 28.
Die Lage der Carboxylgruppe erlaubt uns, ihre Bildung aus der Hydrolyse der –CN-Gruppe vorzuschlagen, letztere wird in aliphatische Moleküle im Allgemeinen durch Substitution eines Halogenids eingeführt, das wiederum von einem Alkohol stammt. Gebildet durch Reduktion eines Ketoncarbonyls.
Die nachfolgenden Schritte sind mit der Friedel-Crafts-Acylierung verknüpft, kombiniert mit der Reduktion von C=O nach der Clemmensen-Methode.
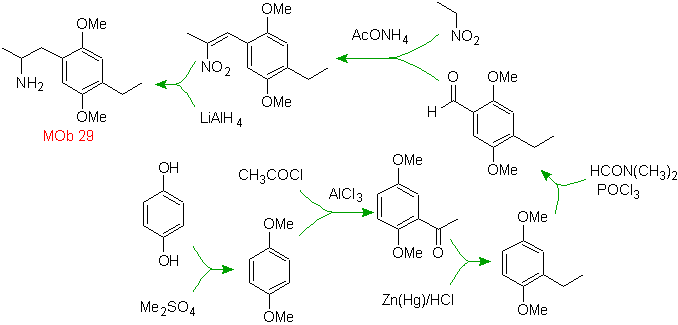
Lösung MOb 29.
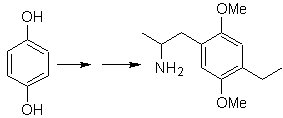
Das Vorhandensein der Aminogruppe im Alkylrest des Arens lässt uns an die Nitrogruppe als ihren Vorläufer denken, und aufgrund des Abstands vom Benzolring kann vorgeschlagen werden, dass sie aus dem Nitro-alpha-beta-ungesättigten gebildet wird , Ergebnis der Kondensation vom Aldoltyp in basischem Medium mit einer an den Benzolring gebundenen -CHO-Gruppe. Diese Formylgruppe wird in den Ring eingefügt durch mit einem disubstituierten Formamid und Phosphoroxychlorid, bekannt als Vilsmeier-Haack-Reaktion. Methode, die nur auf aktivierte aromatische Substrate angewendet werden kann. Um die Ethylgruppe durch Friedel-Crafts-Acylierung einzuführen, ist es notwendig, die -OH-Gruppen des Ausgangsmaterials zuvor in Methylether umzuwandeln.