cliquez sur la chimie
"Click chemistry" est un terme qui a été introduit par KB Sharpless en 2001 pour décrire des réactions à haut rendement, à large portée, ne créant que des sous-produits qui peuvent être éliminés sans chromatographie, sont stéréospécifiques, faciles à réaliser et peuvent être réalisée de manière facile à éliminer. . ou des solvants bénins.Ce concept s'est développé en parallèle avec l'intérêt des industries pharmaceutiques, des matériaux et autres pour la capacité de générer de grandes bibliothèques de composés pour la recherche dans la recherche de découverte.Plusieurs types de réactions ont été identifiés qui répondent à ces critères réactions thermodynamiquement favorisées qui conduisent spécifiquement à un produit, telles que les réactions d'ouverture de cycle nucléophile des époxydes et des aziridines, les réactions carbonyle de type non aldol, telles que la formation d'hydrazone et d'hétérocycle, les additions aux liaisons multiples carbone-carbone, telles que la formation oxydative d'époxydes et les additions de Michael, et les réactions de cycloaddition.
Par exemple, la cycloaddition azoture-alcyne montre qu'elle répond à de nombreuses conditions préalables. De nombreux alcynes et azotures organiques monosubstitués de départ sont disponibles dans le commerce, de nombreux autres peuvent être facilement synthétisés avec une large gamme de groupes fonctionnels, et leur réaction de cycloaddition donne sélectivement des 1,2,3-triazoles.
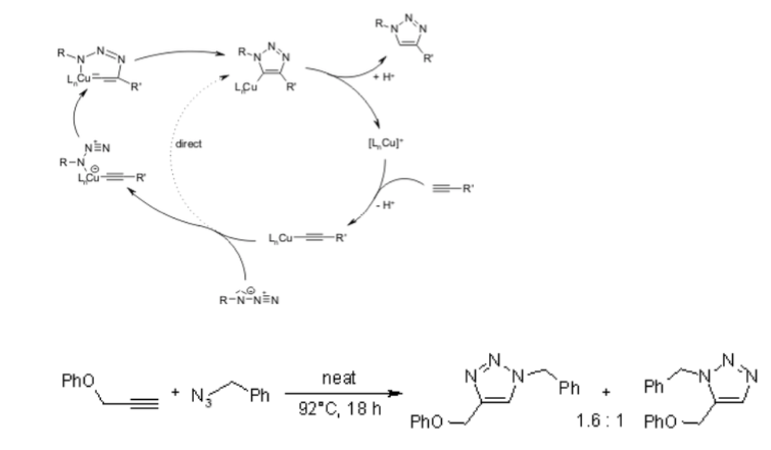
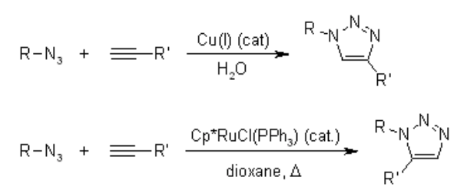
Malheureusement, la cycloaddition huisgen 1,3-dipolaire des alcynes aux azotures nécessite des températures élevées et produit souvent des mélanges des deux régioisomères lorsque des alcynes asymétriques sont utilisés. En ce sens, la cycloaddition 1,3-dipolaire classique échoue en tant que véritable réaction de clic. Une variante catalysée par le cuivre qui suit un mécanisme différent peut être réalisée dans des conditions aqueuses, même à température ambiante. De plus, alors que la cycloaddition classique de Huisgen 1,3-dipolaire donne souvent des mélanges de régioisomères, la réaction catalysée par le cuivre permet la synthèse des régioisomères 1,4-disubstitués spécifiquement. En revanche, une réaction catalysée par le ruthénium développée plus tard donne la régiosélectivité opposée à la formation de triazoles 1,5-disubstitués. Par conséquent, ces réactions catalysées répondent pleinement à la définition de la chimie du clic et se sont concentrées sur la cycloaddition azoture-alcyne en tant que prototype de réaction de clic.
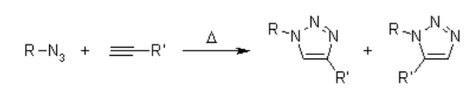
Mécanisme de la cycloaddition 1,3-dipolaire Huisgen Azide-Alcyne :
Pour connaître le mécanisme, il faut lire sur la cycloaddition 1,3-dipolaire également présente dans de nombreuses ozonolyses. Cette réaction est hautement exothermique, mais la barrière d'activation élevée est responsable d'une très faible vitesse de réaction, même à des températures élevées. Un autre inconvénient est la formation de régioisomères, car les deux interactions HOMO-LUMO possibles des substrats sont étroitement liées en termes d'énergie. Ainsi, la réaction thermique donne souvent des mélanges d'environ 1:1 des régioisomères 1,4- et 1,5-substitués.