Pour qu'une molécule absorbe le rayonnement infrarouge, deux conditions doivent être remplies :
- La fréquence du rayonnement (photon) doit être suffisante pour permettre la transition entre les états vibrationnels. En d'autres termes, la fréquence du rayonnement doit coïncider avec la fréquence naturelle du mouvement vibratoire.
- Une molécule n'absorbe le rayonnement infrarouge que lorsque son moment dipolaire interagit avec le champ électrique de l'onde, variant en phase avec lui. En toute logique, ce couplage n'est possible que si les fréquences du rayonnement et de la vibration du lien coïncident. Pour cette raison, les molécules apolaires n'absorbent pas dans l'infrarouge et les molécules moins polaires donnent lieu à des absorptions très faibles.
- Règle de sélection par spectroscopie infrarouge : "seules les liaisons dont la vibration provoque une modification du moment dipolaire de la molécule absorbent dans l'infrarouge".
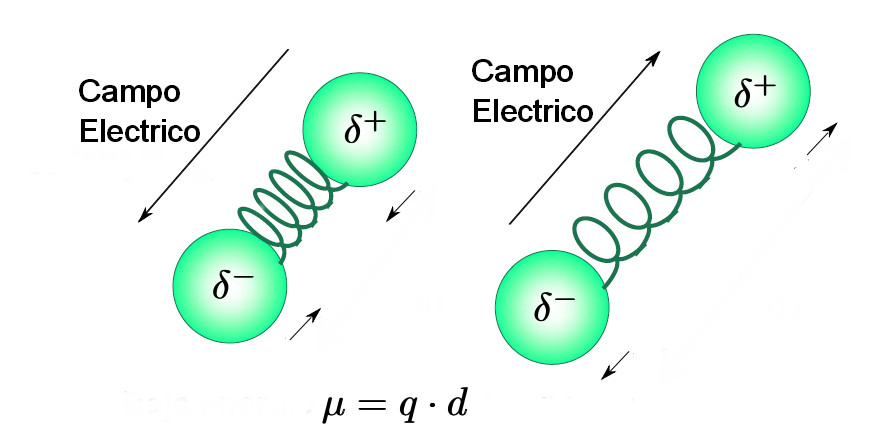
- De plus, plus la variation du moment dipolaire est grande pendant la vibration, plus la bande d'absorption dans le spectre est intense. Les vibrations des liaisons C = O, OH, NH donnent lieu à des bandes intenses et les vibrations de tension de triple liaison ne sont pas observables dans les alcynes symétriques ou trans alcènes à chaînes égales.