Damit ein Molekül Infrarotstrahlung absorbieren kann, müssen zwei Bedingungen erfüllt sein:
- Die Frequenz der Strahlung (Photon) muss ausreichend sein, um den Übergang zwischen Schwingungszuständen zu ermöglichen. Mit anderen Worten muss die Frequenz der Strahlung mit der Eigenfrequenz der Schwingungsbewegung übereinstimmen.
- Ein Molekül absorbiert Infrarotstrahlung nur dann, wenn sein Dipolmoment mit dem elektrischen Feld der Welle interagiert und sich mit diesem in Phase ändert. Diese Kopplung ist logischerweise nur möglich, wenn die Frequenzen der Strahlung und der Schwingung der Verbindung übereinstimmen. Aus diesem Grund absorbieren unpolare Moleküle nicht im Infraroten und weniger polare Moleküle führen zu sehr schwachen Absorptionen.
- Auswahlregel der Infrarotspektroskopie: „Nur solche Bindungen, deren Schwingung eine Änderung des Dipolmoments des Moleküls bewirkt, absorbieren im Infraroten“.
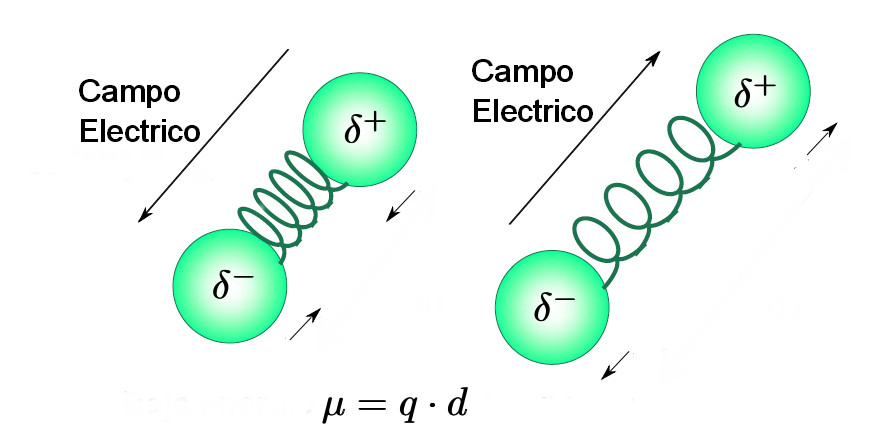
- Je größer die Variation des Dipolmoments während der Vibration ist, desto intensiver ist außerdem die Absorptionsbande im Spektrum. Schwingungen von C=O-, OH-, NH-Bindungen führen zu intensiven Banden, und Schwingungen der Dreifachbindungsspannung sind in symmetrischen Alkinen oder trans-Alkenen mit gleichen Ketten nicht beobachtbar.