-
Details
-
Germán Fernández
-
MOLEKULARE FORMELN
-
Zugriffe: 87366
Derzeit sind mehr als 30 Millionen chemische Verbindungen bekannt, von denen 1 Million anorganisch und der Rest organisch sind. Chemiker bestimmen die physikalischen und chemischen Eigenschaften dieser Stoffe (Schmelz- und Siedepunkte, Löslichkeit, Dichte...). Die von Chemikern am meisten begehrte Information ist jedoch die Bestimmung der Struktur der Verbindung, aus welcher Art von Atomen sie besteht und wie diese Atome gebunden sind.
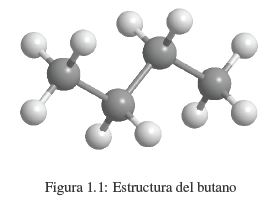
Wir wissen, dass eine Substanz wie Butan aus Kohlenstoff und Wasserstoff besteht. Jedes Molekül enthält 4 Kohlenstoffatome und 10 Wasserstoffatome, was durch die Formel C 4 H 10 dargestellt wird, die als Molekularformel bezeichnet wird. Wir wissen auch, dass Kohlenstoffatome zu einer linearen Kette verbunden sind. 3 Wasserstoffe sind an den ersten Kohlenstoff gebunden, 2 Wasserstoffe an den zweiten Kohlenstoff, 2 Wasserstoffe an den dritten Kohlenstoff und die letzten 3 Wasserstoffe an den vierten Kohlenstoff.
Weiterlesen: Molekulare Formeln
-
Details
-
Germán Fernández
-
MOLEKULARE FORMELN
-
Zugriffe: 96380
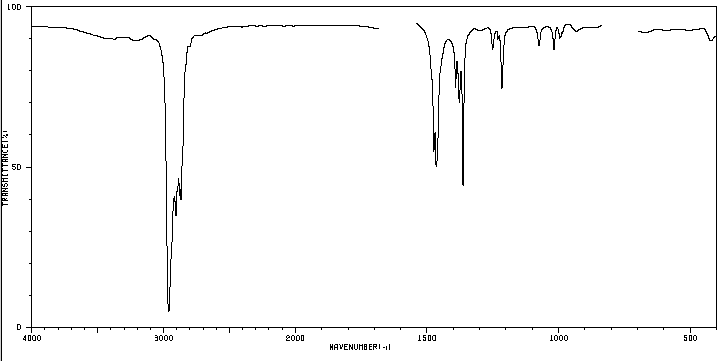
Es besteht darin, die prozentuale Zusammensetzung (nach Masse) eines Stoffes experimentell zu bestimmen. Somit beträgt die prozentuale Zusammensetzung für eine Verbindung mit der Summenformel C 4 H 10 : 82,66 % C und 17,34 % H.
Die Elementaranalyse einer Verbindung wird in einem Apparat, Analysator genannt, durchgeführt, in dem eine gewogene Probe mit großer Präzision (etwa 5 mg) verbrannt wird. Kohlenstoff wird in CO 2 , Wasserstoff in H 2 O und Stickstoff in N 2 umgewandelt, bestimmt durch Gaschromatographie. Sauerstoff wird normalerweise nicht analysiert und durch Differenz bestimmt.
Weiterlesen: Elementare Analyse
-
Details
-
Germán Fernández
-
MOLEKULARE FORMELN
-
Zugriffe: 90313
Aus der zentesimalen Zusammensetzung einer chemischen Verbindung können wir ihre Summenformel bestimmen. Die Summenformel ergibt sich aus der empirischen unter Verwendung der molekularen Masse der Verbindung, die durch Massenspektrometrie bestimmt werden kann.
Bestimmung der Summen- und Summenformel von Kortison
Die prozentuale Zusammensetzung von Kortison beträgt: 69,96 % C; 7,83 % H und 22,21 % O. Bestimmen Sie die Summenformel. Wenn Sie wissen, dass die Molekülmasse 360,43 beträgt, erhalten Sie die Summenformel.
Weiterlesen: Berechnung von Summen- und Summenformeln
-
Details
-
Germán Fernández
-
MOLEKULARE FORMELN
-
Zugriffe: 80291
Der Ungesättigtheitsindex eines Moleküls ist definiert als die Summe der Anzahl der Bindungen \(\pi\) und der Anzahl der vorhandenen Zyklen. Alkane sind gesättigte Kohlenwasserstoffe, da sie keine \(\pi\)-Bindungen oder -Zyklen enthalten und die Summenformel \(C_nH_{2n+2}\) haben. Um den Ungesättigtheitsindex einer Verbindung zu berechnen, müssen wir nur die Anzahl der Wasserstoffatome mit denen vergleichen, die sie haben würden, wenn es sich um ein Alkan mit der gleichen Anzahl an Kohlenstoffatomen handeln würde. Diese Wasserstoffdifferenz dividiert durch 2 ergibt den Ungesättigtheitsindex.
Alkene sind Verbindungen, die Kohlenstoff-Kohlenstoff-Doppelbindungen enthalten. Alkene entsprechen der Summenformel \(C_nH_{2n}\). Für die gleiche Anzahl von Kohlenstoffen haben sie zwei Wasserstoffe weniger als ein Alkan, sie werden als ungesättigte Verbindungen bezeichnet (sie haben Ungesättigtheit).
Weiterlesen: Ungesättigtheitsindex