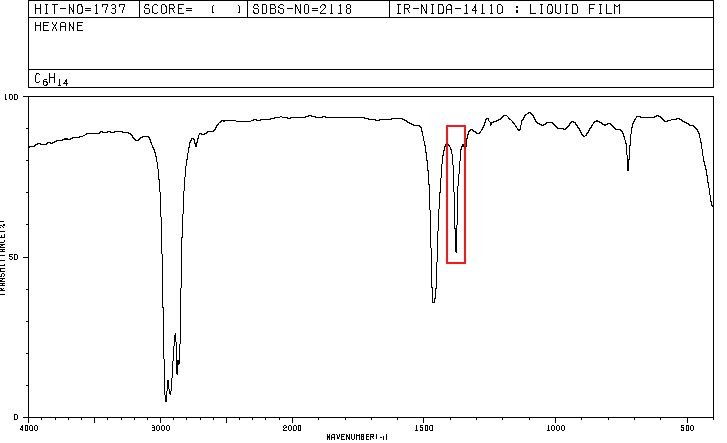
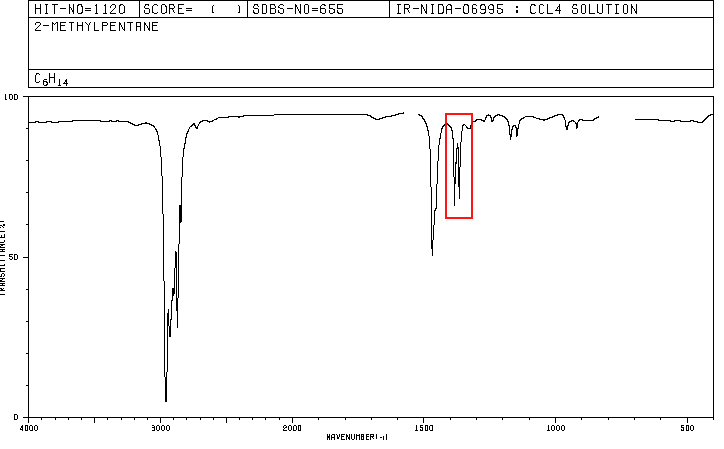
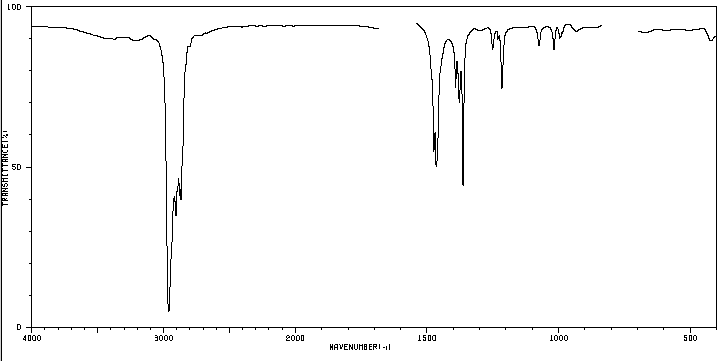
Un composé organique dont la composition en pourcentage est de 83,63% de carbone et 16,37% d'hydrogène avec une masse moléculaire de 86,11, présente le spectre IR suivant.
Déterminer la structure du composé.
1. Détermination de la formule empirique
\(C:\frac{83.63}{12.01}=6.96;\;\;\; H:\frac{16.37}{1.008}= 16.24\). Divisant par la plus petite valeur \(C:\frac{6.96}{6.96}=1;\;\;\;H:\frac{16.24}{6.96}=2.33\) . En multipliant par 3, nous obtenons des valeurs entières C:3 H:7. Par conséquent, la formule empirique est \((C_3H_7)_n\).
2. Détermination de la formule moléculaire
\(n=\frac{86.11}{3\fois 12.01+7\fois 1.008}=2\). La formule moléculaire est : C 6 H 14
3. Détermination de l'indice d'insaturation.
En comparant avec la formule \(C_nH_{2n+2}\) on observe que l'alcane de 6 carbones a 14 hydrogènes. Par conséquent, notre formule moléculaire est dépourvue d'insaturations (alcane).
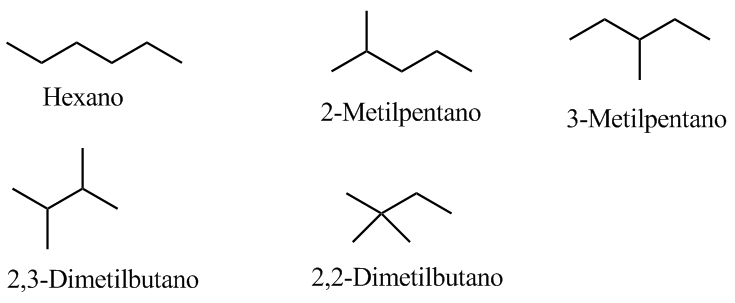
4. Écris les isomères possibles.
Comme il s'agit d'un composé saturé, il ne contiendra ni cycles ni doubles liaisons.
5. Etude du spectre pour déterminer à quel isomère il appartient.
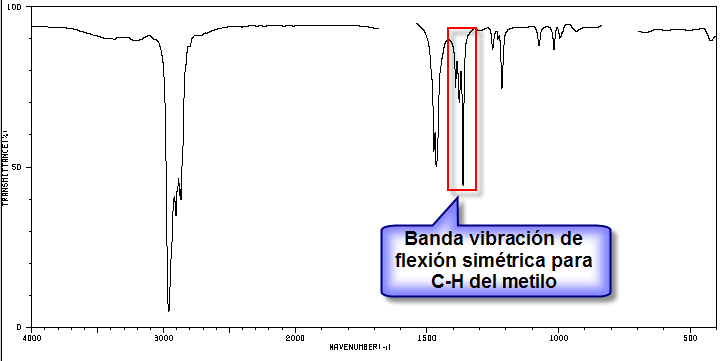
La bande indiquée, due à la vibration de flexion symétrique des liaisons méthyle CH, est divisée pour les groupes isopropyle et tert-butyle. Dans le cas de l'isopropyle, deux bandes d'égale intensité apparaissent à 1380 et 1370 cm -1 . Dans le cas du tert-butyle, la bande 1380 a la moitié de l'intensité. Comme on peut le voir dans notre spectre, les deux bandes sont d'intensité différente, ce qui indique la présence d'un groupe tert-butyle dans la molécule. Sur les 5 isomères proposés, un seul présente ce groupe, le 2,2-Diméthylbutane.
Les spectres pour l'hexane et le 2-méthylpentane sont inclus ci-dessous.