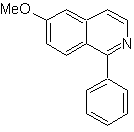
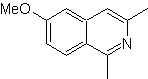
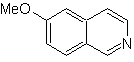
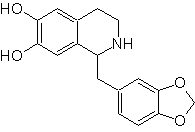
Синтез изохинолина
(методом разъединений)
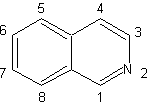
| Изохинолины структурно отличаются от хинолинов положением азот, так как последний не расплавляется, поэтому он обладает «алифатической реакционной способностью». Он не встречается в природе в свободном виде, но изохинолиновый цикл встречается в некоторых алкалоидах в ароматической или восстановленной форме, например в папаверине. |
Наиболее известные синтетические методы получения изохинолинов начинаются с 2-фенилэтиламинов и включают циклизацию за счет дополнительного углерода, обеспечиваемого карбонильной группой другого соединения.
Основными синтетическими методами являются: синтез Померанца-Фрича, синтез Бишлера-Напиральского, синтез Пикте-Гамса и синтез Пикте-Шпенглера.
1. Синтез POMERANZ-FRITSCH.
Этот метод синтеза изохинолина происходит в две стадии:
к.
Сначала бензальдегид (1,3-электрофил-нуклеофил) конденсируют с диэтилацеталем аминоацетальдегида (1,3-нуклеофил-электрофил) с образованием стабильного альдимина.
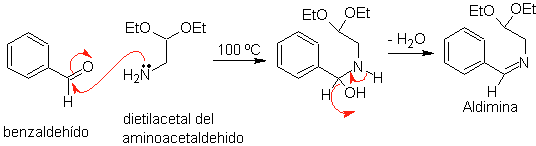
б.
Впоследствии альдимин циклизуется в сильнокислой среде в имин с одновременным удалением этанола с образованием изохинолина.
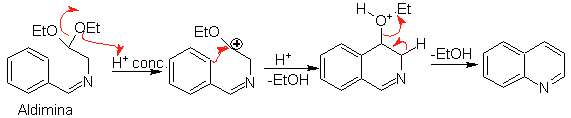
Эта вторая стадия, представляющая собой электрофильное замещение, подвержена влиянию электронодонорных или акцепторных заместителей на бензольное кольцо в указанной реакции. Однако из-за гидролиза образующегося имина в сильнокислой среде, используемой в реакции, снижается выход процесса.
Этот метод позволяет получить доступ к C-1-замещенным изохинолинам, для которых были протестированы ароматические кетоны, с очень низкими выходами. Однако был достигнут больший успех при использовании варианта соответствующим образом замещенных бензиламинов в качестве 1,4-динуклеофилов и диэтилацеталя глиоксаля в качестве 1,2-диэлектрофилов.
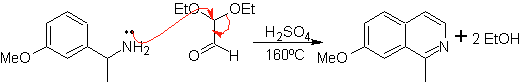
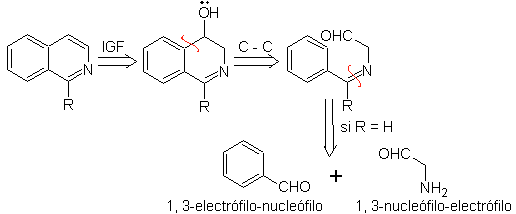
Следует уточнить, что метод Померанца-Фрича и его вариант, проанализированные ранее, не позволяют получать изохинолины, замещенные в положениях С-3 и С-4 гетероатома. Ретросинтетический анализ этого метода показывает возможные промежуточные продукты, участвующие в реакции, и вероятные исходные материалы.
Предложите схему синтеза каждого из следующих изохинолинов: | МОБ 107
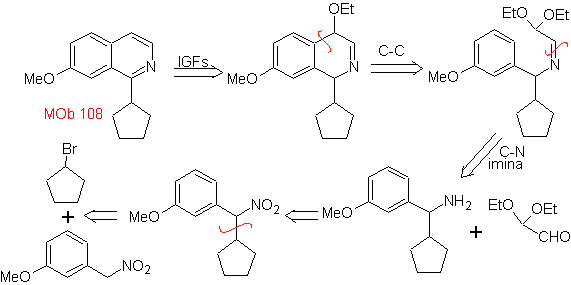
| МОБ 108
|
МОБ 107 . Ретросинтетический анализ . Отключение
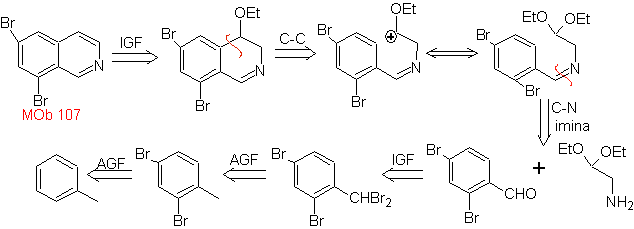
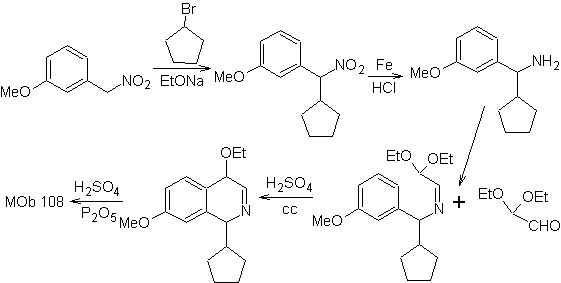
MOb 108. Ретросинтетический анализ . Наличие заместителя на C1 изохинолина, приводит к отключению
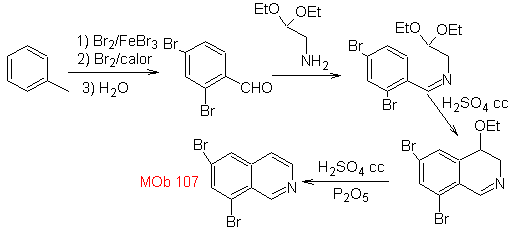
Синтез Производное бензиламина получают для взаимодействия с диацеталем аминоальдегида в соответствии с синтезом Померанца-Фрича с образованием
2. Синтез БИСХЛЕРА-НАПИЕРАЛЬСКОГО .
Этот метод синтеза изохинолинов включает реакцию фенетиламина (1,5-динуклеофил) с хлорангидридом или ангидридом (электрофил) с образованием амида, циклизация которого с потерей воды приводит к 2,4-дигидроизохинолину с заместителем при C-1, который окисляется до изохинолина с помощью Pd-C или фенилдисульфида.
Стадия циклизации представляет собой электрофильное ароматическое замещение, и поэтому ей благоприятствуют электронодонорные заместители в ароматическом кольце фенетиламина. М-замещенные фенетиламины приводят исключительно к С-6 замещенным изохинолинам из-за циклизации в пара-положении по отношению к активирующей группе.
Ретросинтетический анализ изохинолинов, полученных этим методом, выглядит следующим образом:
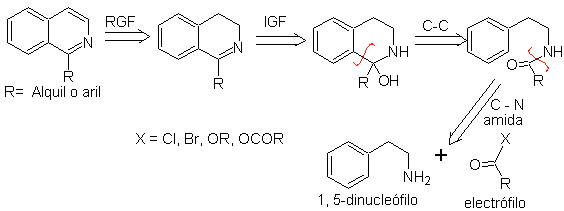
Агенты циклизации, наиболее часто используемые в этом синтезе:
к.
P 2 O 5 (пятиокись фосфора)
б.
POCl 3 (оксихлорид фосфора) и
в.
SOCl 2 (тионилхлорид)
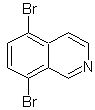
Предложите план синтеза следующих изохинолинов: | МОБ 109
| МОБ 110
|
МОБ 109 . Ретросинтетический анализ .
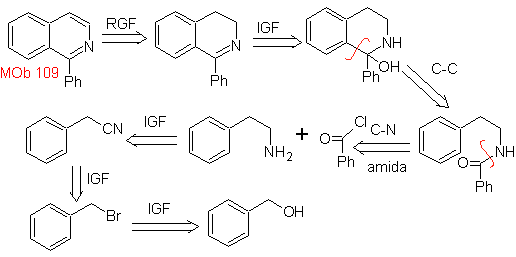
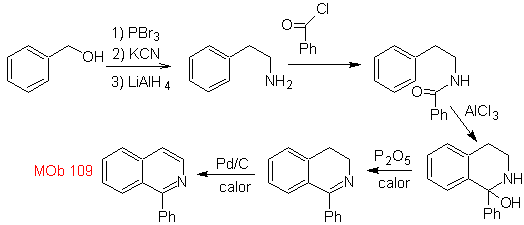
Синтез. Бензиловый спирт является хорошим исходным материалом для образования фенетиламина, который соединяется с бензоилхлоридом. Продукт циклизуют и ароматизируют Pd/C и нагревают до образования
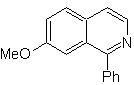
MOb 110. Ретросинтетический анализ.
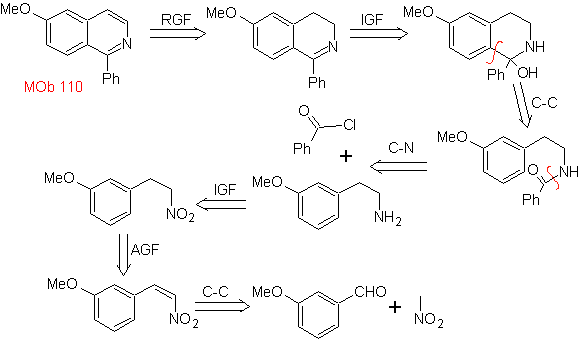
Синтез. Синтез
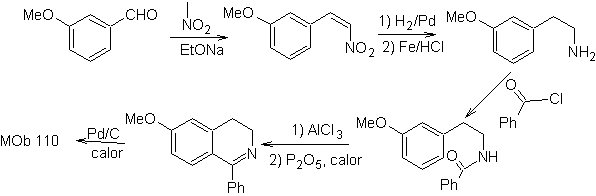
3.
Синтез ПИКТЕ-ГАМС.
Это вариант синтеза Бишлера-Напиральского, в этом методе используются потенциально ненасыщенные фенетиламины с получением полностью ароматического гетероцикла, поэтому применение окислителей не требуется.
Ретросинтетический анализ этого метода показывает следующие потенциальные повторные соединения и исходные материалы.
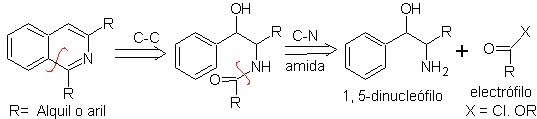
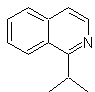
Предложите схему синтеза следующих изохинолинов : | МОБ 111.
|
МОБ 111 . Ретросинтетический анализ . Чтобы инициировать отключение
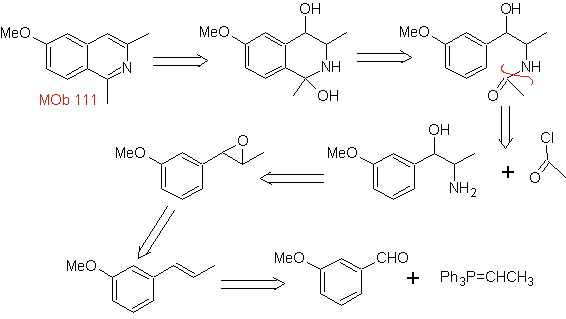
синтез . Применяется синтез Пикте-Гамса, поэтому нет необходимости использовать окислитель в конце, чтобы достичь образования
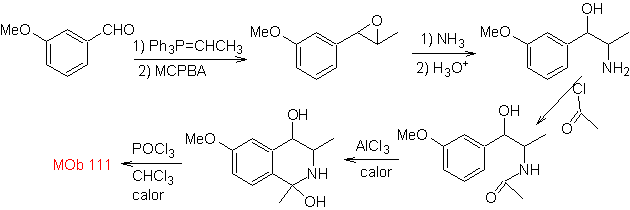
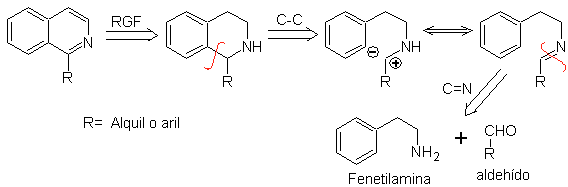
Фенетиламины также могут реагировать с альдегидами с хорошими выходами, давая альдимины, способные циклизоваться в кислой среде до 1,2,3,4-тетрагидроизохинолинов, которые необходимо окислить для получения изохинолинов.
Эта циклизация требует подходящего размещения активирующих заместителей для активации орто-положений по отношению к аминоэтильной группе, поэтому замыкание кольца всегда происходит в пара-положении к активатору.
Когда ароматическое кольцо активируется гидроксильными заместителями, замыкание кольца происходит в очень мягких условиях из-за сильного активирующего действия ОН-
Ретросинтетический анализ изохинолина, образованного методом Пикте-Шпенглера , показывает следующие разъединения и исходные материалы:
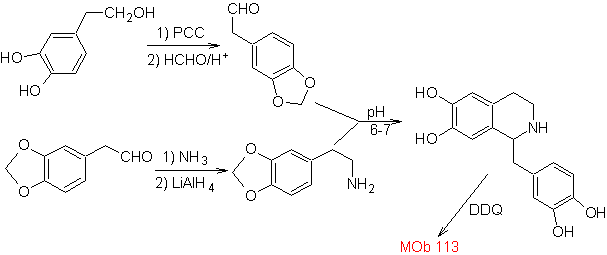
Предложите план синтеза следующих изохинолинов: | МОБ 112
| ….. | МОБ 113
|
MOb 112. Ретросинтетический анализ .
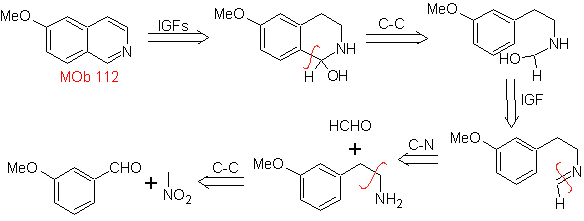
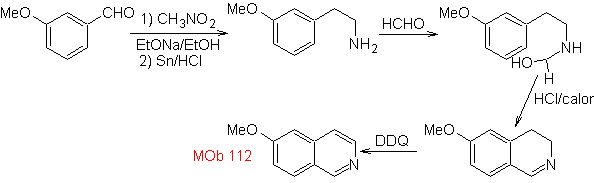
синтез . Циклизация происходит в кислой среде, и ДДГ используется для ароматизации образующегося гидроизохинолина для получения
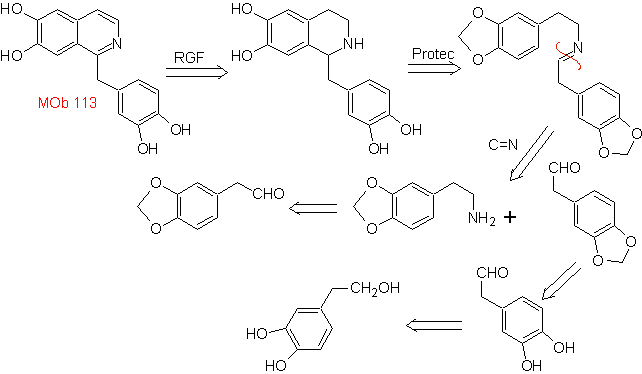
Синтез Синтез Пикте-Шпенглера применяется для формирования
Аме Пикте (1857—1937) был одним из шести членов швейцарского представительства и исполнял обязанности секретаря Женевского химического конгресса . Как представитель