В стереохимия, асимметричная индукция (также энантио-индукция) в химическая реакция описывает преимущественное формирование энантиомер или диастереомер с другой, в результате влияния характеристики хиральный присутствует в субстрат, реагент, катализатор или окружающей среды. Асимметричная индукция является ключевым элементом в асимметричный синтез.
Асимметричная индукция была введена Эмиль Фишер, основанный на его работе о углеводы Существует несколько видов индукции.
внутренняя асимметричная индукция использует хиральный центр, связанный с реактивным центром посредством ковалентной связи, и остается таковой во время реакции. в индукционное реле асимметричное хиральная информация вводится на отдельном этапе и снова удаляется в отдельной химической реакции. Специальные синтоны называются хиральные вспомогательные вещества. в внешней асимметричной индукции киральная информация вводится в переходное состояние через катализатор или хиральный лиганд. Этот метод асимметричный синтез это экономически наиболее желательно.
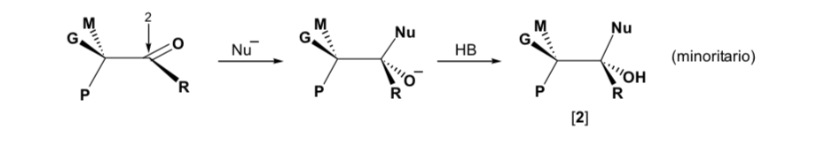
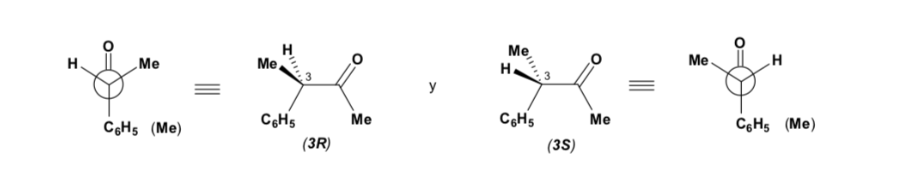
Стереоселективность в реакции нуклеофильного присоединения к карбонилам (правила Крама)
В реакциях нуклеофильного присоединения атом углерода карбонильной группы может быть превращен в асимметрический атом углерода, в зависимости от типа используемого нуклеофила и алкильных радикалов, первоначально присоединенных к С=О.
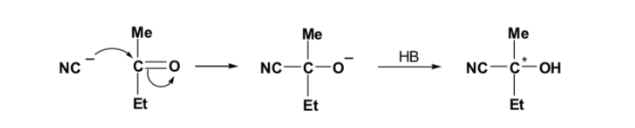
Если карбонильное соединение и нуклеофил не хиральны, получается эквимолярная смесь двух энантиомеров (рацемическая):
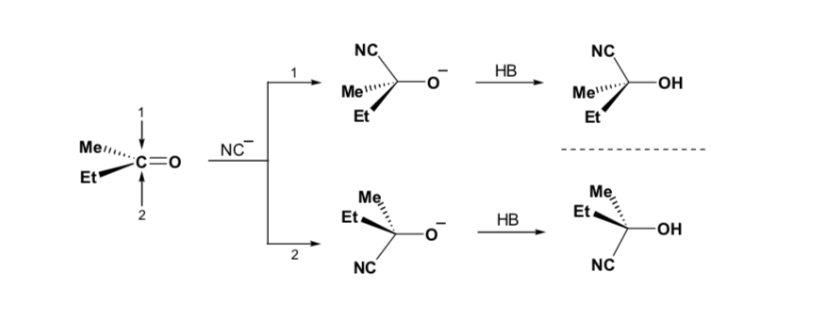
Однако, когда карбонильное соединение является хиральным, вероятность того, что нуклеофил будет реагировать каждой из двух сторон карбонильной группы, не одинакова. Стереопомеха приводит к тому, что реакция на одной из граней оказывается предпочтительной, и в результате получается смесь диастереоизомеров в разных пропорциях ( асимметричная индукция ):
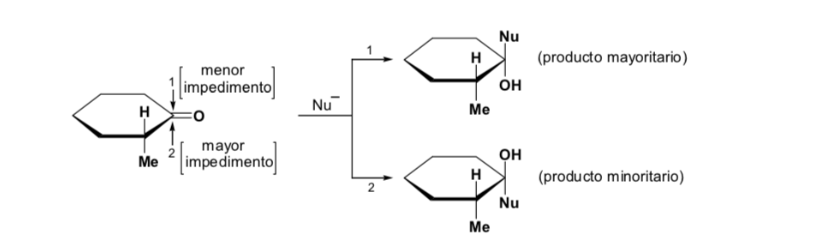
Основной диастереомер образуется, когда нуклеофил реагирует с карбонильной группой на наименее затрудненной стороне, а конформация субстрата такова, что карбонильная группа окружена менее объемными группами, присоединенными к асимметричному Cα.
[карбонильная группа, окруженная менее объемными группами: H и Me ]
Правило Крама относится к реакции одного из стереоизомеров , образующих пару энантиомеров, а не к реакции рацемата с нуклеофилом.
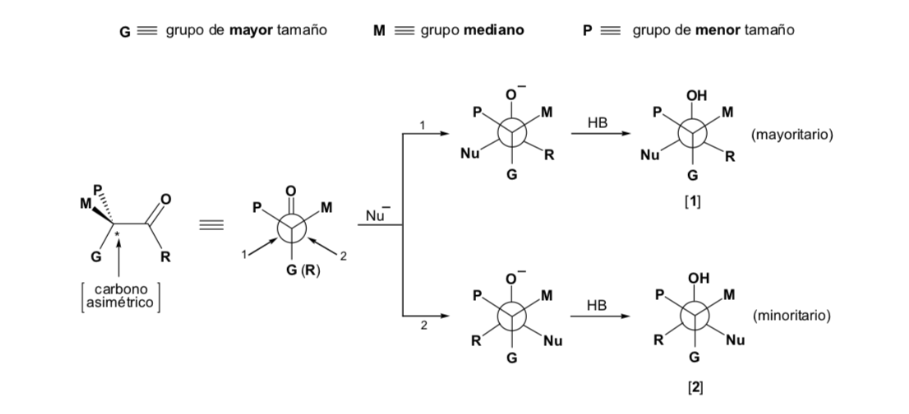
Подходят к нуклеофилу со стороны, где расположены P и G :
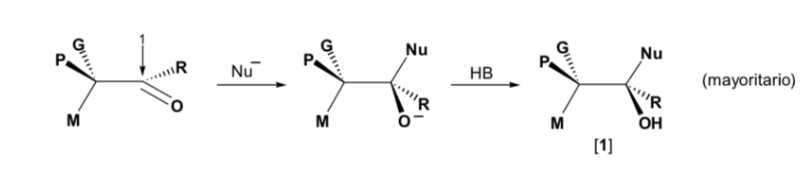
Подходят к нуклеофилу со стороны, где расположены M и G :

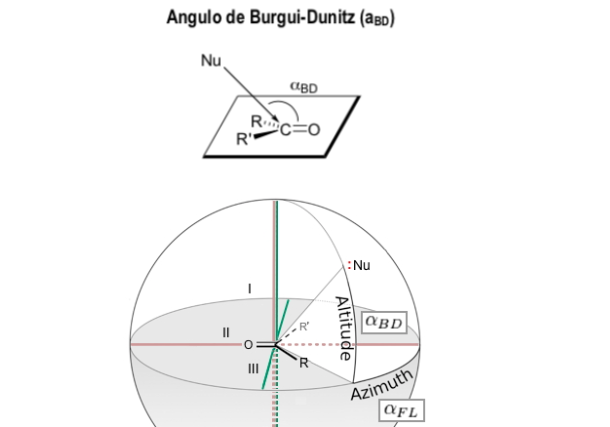
Угол Бурджи-Дуница
Угол Бюрги-Дуница (угол BD) является одним из двух углов, которые полностью определяют геометрию «атаки» (приближение столкновения) нуклеофила на ненасыщенный тригональный центр в молекуле, первоначально карбонильный центр в органическом кетоне, но теперь это распространяется на карбонилы альдегидов, сложных эфиров и амидов, а также на алкены (олефины).
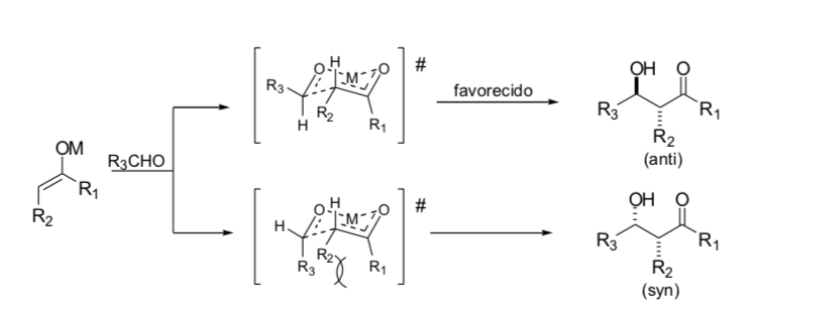
Модель Циммермана - тракслер
Циммерман и Тракслер предположили, что альдольная реакция с енолятами металлов протекает через перициклический процесс, подобный стулу. На практике стереохимия может сильно зависеть от металла. Только некоторые металлы, такие как бор, надежно следуют указанным путям.
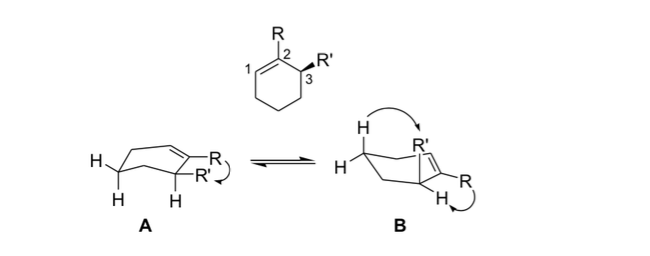
аллильный стресс
В стереохимии аллильное напряжение или 1,3-аллильное напряжение представляет собой энергию напряжения, возникающую в результате неблагоприятной молекулярной конформации для аллильной группы, продукт взаимодействия между заместителем на одном конце олефина с аллильным заместителем на другом конце.
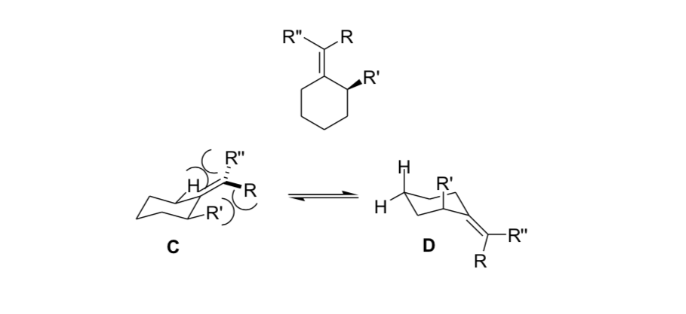
Химики-органики используют эту жесткость, возникающую в результате деформации аллила, для получения асимметричных реакций.
Замена в альфа-положении енолятов: введение нового стереогенного центра:
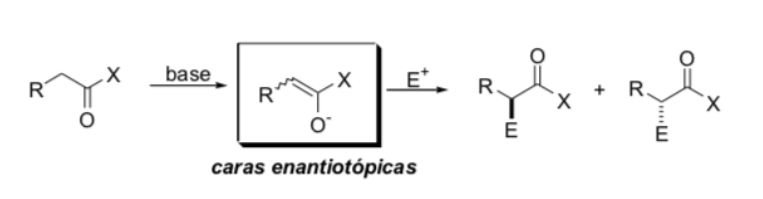
Факторы, контролирующие стереоселективность
а) енолятная геометрия
б) источники хиральности присутствуют либо в еноляте, либо в электрофиле (источник асимметричной информации)
в) стереоэлектронные эффекты
Источники для расширения информации:
1) Го-Цян Линь, Юэ-Мин Ли, Альберт С.К. Чан. Принципы и приложения асимметричного синтеза. Эд Wiley-Interscience. Великобритания, 2001 год.
2) Марк Риццакаса и Майкл Перкинс. Стехиометрический асимметричный синтез. Эд Шеффилд Академик Пресс. США и Канада. 2000.
3) Джонатан М.Дж. Уильямс. Катализ в асимметричном синтезе. Эд Шеффилд Академик Пресс. США и Канада. 1999.
4) Р.А. Айткен и С.Н. Кулени. Асимметричный синтез. Эд Блэки Академический и профессиональный. Великобритания, 1992 год.
5) Гроссман Р.Б. Искусство написания разумных механизмов органических реакций. Спрингер, Нью-Йорк. 2003 г.
6) нормандская РПЦ; Коксон Дж. М. Принципы органического синтеза. CRC Press, Бока-Ратон. 1993 г.