Es gibt drei Zonen des elektromagnetischen Spektrums, die für die Bestimmung chemischer Verbindungen von besonderem Interesse sind:
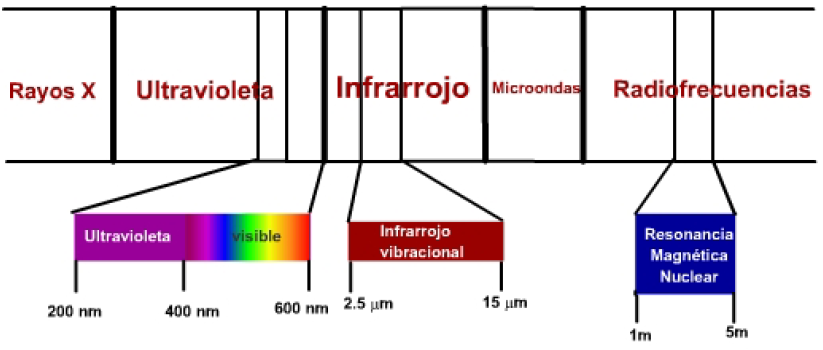
- Sichtbare ultraviolette Strahlung hat eine ausreichende Energie, um molekulare Elektronenübergänge bei höheren Energieniveaus zu erzeugen. Es ist die sogenannte UV-Spektroskopie, deren Nützlichkeit hauptsächlich auf die Bestimmung von Molekülen mit Ungesättigtheiten beschränkt ist.
- Infrarotstrahlung erzeugt Übergänge zwischen Schwingungsniveaus eines Moleküls. Die Bindungen zwischen den Atomen eines Moleküls sind nicht starr, sondern schwingen um eine Gleichgewichtsposition herum, und Infrarotstrahlung ist in der Lage, diese Bindungen auf höhere Schwingungsenergieniveaus zu bringen. Dies wird als Infrarot (IR)-Spektroskopie bezeichnet.
- Radiowellen haben ausreichend Energie, um Atomkerne, die einem Magnetfeld ausgesetzt sind, in Resonanz zu versetzen. Diese Technik wird Kernspinresonanz (NMR)-Spektroskopie genannt.
Sowohl die Schwingungs- als auch die Elektronen- und die Kernspin-Energieniveaus werden quantisiert, und die Energien, die erforderlich sind, um das System von einem niedrigeren Niveau auf ein höheres zu bringen, sind durch diskrete Werte gegeben, die für jedes System charakteristisch sind. Ein Molekül absorbiert elektromagnetische Strahlung, wenn das Produkt $h\nu$ mit der Energiedifferenz zwischen dem niedrigeren Niveau, in dem es sich befindet, und dem höheren, das es fördert, übereinstimmt.