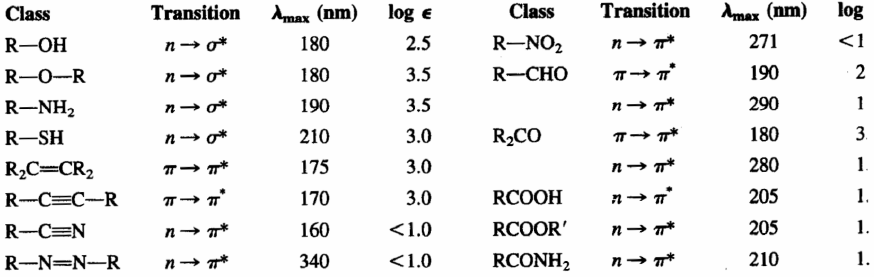
- Alkane. Seine Absorptionsbanden sind auf $\sigma\rightarrow\sigma^{\ast}$-Übergänge von CC- und CH-Bindungen zurückzuführen. Diese Übergänge sind hochenergetisch und finden bei Wellenlängen unter 150 nm statt und sind daher in herkömmlichen Spektrophotometern nicht beobachtbar. Aufgrund dieser Eigenschaft können sie als Lösungsmittel für die zu analysierende Probe verwendet werden, da sie ihre Signale nicht stören.
- Alkene und Alkine. Sie zeigen Absorptionsbanden aufgrund von $\pi\rightarrow\pi^{\ast}$-Übergängen der CC-Dreifachbindung. Dieser Übergang ist energieärmer als bei Alkanen und tritt bei größeren Wellenlängen auf (Alkene: 175 nm; Alkine: 170 nm). Die Doppel- und Dreifachbindung sind die Chromophorgruppen dieser Moleküle.
- Ether, Thiole, Sulfide, Amine: In diesem Fall wird die chromophore Gruppe durch das Heteroatom (O,S,N) und die Atome, die es verbinden, gebildet. Das Heteroatom präsentiert freie Elektronenpaare und der Übergang, der die Absorption erzeugt, ist $n\rightarrow\sigma^{\ast}$. Diese Absorptionsbande erscheint bei etwa 175–200 nm für Alkohole, Ether und Amine und bewegt sich für Sulfide zu 200–220 nm.
- Aldehyde, Ketone, Säuren und Derivate. Die chromophore Gruppe dieser Verbindungen ist Carbonyl (C=O). Da Sauerstoff freie Elektronenpaare hat, ist der Übergang mit der niedrigsten Energie $n\rightarrow\pi^{\ast}$, aber es ist ein verbotener Übergang ($\epsilon_{max}=15$), da es keine Überlappung gibt die beteiligten Orbitale. Der nächstniedrigere Energieübergang ist $\pi\rightarrow\pi^{\ast}$, beobachtbar bei $\lambda_{max}=188\;nm$, mit einem molaren Absorptionsvermögen von 900.
Die folgende Tabelle zeigt die Absorptionen der wichtigsten Chromophorgruppen.