Chemie klick
„Klick-Chemie“ ist ein Begriff, der 2001 von KB Sharpless eingeführt wurde, um Reaktionen zu beschreiben, die eine hohe Ausbeute haben, einen breiten Anwendungsbereich haben, nur Nebenprodukte erzeugen, die ohne Chromatographie entfernt werden können, stereospezifisch sind, einfach durchzuführen und sein können Dieses Konzept entwickelte sich parallel zum Interesse in der Pharma-, Material- und anderen Industrien an der Fähigkeit, große Bibliotheken von Verbindungen für die Forschung in der Entdeckungsforschung zu generieren identifiziert, die diese Kriterien erfüllen thermodynamisch begünstigte Reaktionen, die spezifisch zu einem Produkt führen, wie z. wie oxidative Bildung von Epoxiden und Michael-Additionen und Cycloadditionsreaktionen.
Beispielsweise zeigt die Azid-Alkin-Cycloaddition, dass sie viele der Voraussetzungen erfüllt. Viele der monosubstituierten Ausgangsalkine und organischen Azide sind im Handel erhältlich, viele andere können leicht mit einer breiten Palette funktioneller Gruppen synthetisiert werden, und ihre Cycloadditionsreaktion ergibt selektiv 1,2,3-Triazole.
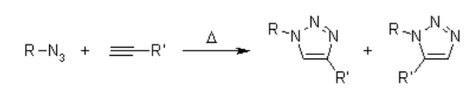
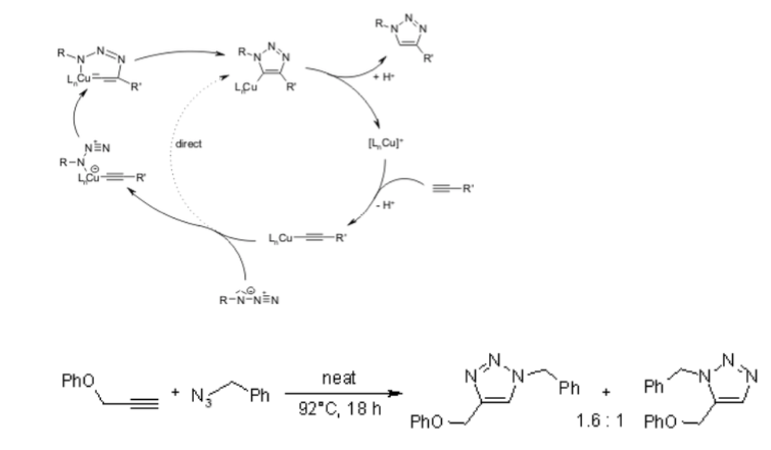
Leider erfordert die 1,3-dipolare Huisgen-Cycloaddition von Alkinen an Azide erhöhte Temperaturen und führt häufig zu Mischungen der beiden Regioisomere, wenn asymmetrische Alkine verwendet werden. In diesem Sinne versagt die klassische 1,3-dipolare Cycloaddition als echte Klickreaktion. Eine kupferkatalysierte Variante, die einem anderen Mechanismus folgt, kann unter wässrigen Bedingungen sogar bei Raumtemperatur durchgeführt werden. Während die klassische 1,3-dipolare Huisgen-Cycloaddition häufig Mischungen von Regioisomeren ergibt, ermöglicht die kupferkatalysierte Reaktion außerdem speziell die Synthese der 1,4-disubstituierten Regioisomere. Im Gegensatz dazu ergibt eine später entwickelte Ruthenium-katalysierte Reaktion die entgegengesetzte Regioselektivität zur Bildung von 1,5-disubstituierten Triazolen. Daher erfüllen diese katalysierten Reaktionen vollständig die Definition der Klick-Chemie und haben sich auf die Azid-Alkin-Cycloaddition als Prototyp einer Klick-Reaktion konzentriert.
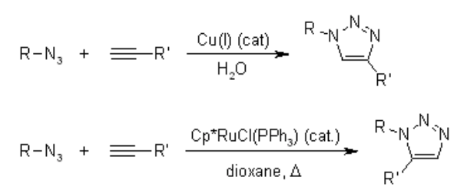
Mechanismus der 1,3-dipolaren Huisgen-Azid-Alkin-Cycloaddition:
Um den Mechanismus zu kennen, sollte man über die 1,3-dipolare Cycloaddition lesen, die auch bei vielen Ozonolysen vorhanden ist. Diese Reaktion ist stark exotherm, aber die hohe Aktivierungsbarriere ist selbst bei erhöhten Temperaturen für eine sehr niedrige Reaktionsgeschwindigkeit verantwortlich. Ein weiterer Nachteil ist die Bildung von Regioisomeren, da die beiden möglichen HOMO-LUMO-Wechselwirkungen der Substrate energetisch eng verwandt sind. Daher ergibt die thermische Reaktion oft etwa 1:1-Mischungen sowohl der 1,4- als auch der 1,5-substituierten Regioisomere.