clique de química
A “química do clique” é um termo introduzido por KB Sharpless em 2001 para descrever reações de alto rendimento, amplo escopo, que criam apenas subprodutos que podem ser removidos sem cromatografia, são estereoespecíficas, fáceis de realizar e podem ser realizados de maneiras fáceis de remover. . ou solventes benignos. Esse conceito se desenvolveu em paralelo com o interesse nas indústrias farmacêutica, de materiais e outras indústrias na capacidade de gerar grandes bibliotecas de compostos para pesquisa em pesquisa de descoberta. Vários tipos de reação foram identificados que atendem a esses critérios reações termodinamicamente favorecidas que levam especificamente a um produto, como reações nucleofílicas de abertura de anel de epóxidos e aziridinas, reações carboniladas não aldólicas, como hidrazona e formação de heterociclos, adições a ligações múltiplas carbono-carbono, como a formação oxidativa de epóxidos e adições de Michael, e reações de cicloadição.
Por exemplo, a cicloadição de azida-alcino mostra que atende a muitos dos pré-requisitos. Muitos dos alcinos monossubstituídos iniciais e azidas orgânicas estão comercialmente disponíveis, muitos outros podem ser facilmente sintetizados com uma ampla gama de grupos funcionais, e sua reação de cicloadição fornece seletivamente 1,2,3-triazóis.
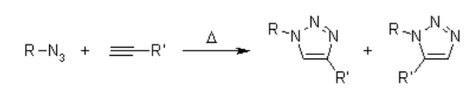
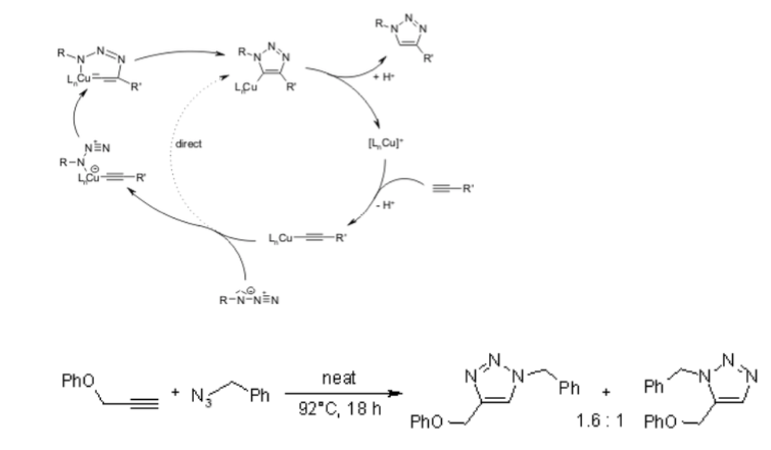
Infelizmente, a cicloadição huisgen 1,3-Dipolar de alcinos a azidas requer temperaturas elevadas e freqüentemente produz misturas dos dois regioisômeros quando alcinos assimétricos são usados. Nesse sentido, a clássica cicloadição 1,3-dipolar falha como uma verdadeira reação de clique. Uma variante catalisada por cobre que segue um mecanismo diferente pode ser realizada em condições aquosas, mesmo à temperatura ambiente. Além disso, enquanto a clássica cicloadição de Huisgen 1,3-dipolar muitas vezes dá misturas de regioisômeros, a reação catalisada por cobre permite a síntese dos regioisômeros 1,4-dissubstituídos especificamente. Em contraste, uma reação catalisada por rutênio desenvolvida posteriormente dá a regiosseletividade oposta à formação de triazóis 1,5-dissubstituídos. Portanto, essas reações catalisadas atendem totalmente à definição de química de clique e se concentram na cicloadição de azida-alcino como um protótipo de reação de clique.
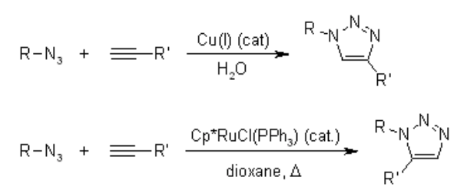
Mecanismo da cicloadição 1,3-dipolar Huisgen Azide-Alcino:
Para conhecer o mecanismo, deve-se ler sobre a cicloadição 1,3-dipolar também presente em muitas ozonólises. Essa reação é altamente exotérmica, mas a alta barreira de ativação é responsável por uma taxa de reação muito baixa, mesmo em temperaturas elevadas. Outra desvantagem é a formação de regioisômeros, uma vez que as duas possíveis interações HOMO-LUMO dos substratos estão intimamente relacionadas em termos de energia. Assim, a reação térmica geralmente fornece misturas de aproximadamente 1:1 de ambos os regioisômeros substituídos em 1,4 e 1,5.