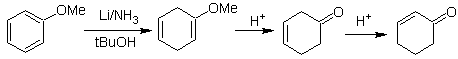Bildung von Enolen und Enolaten
Das Alpha- Kohlenstoffatom von Verbindungen, die die Carbonylgruppe enthalten (Aldehyde, Ketone, Ester, Diketone, Diester, Nitrate, Nitrile usw.), ist das Zentrum vieler CC-Bindungsbildungsreaktionen. Aufgrund der Acidität des H a unterliegen sie in Gegenwart einer geeigneten Base einer -Deprotonierung mit nachfolgender Bildung eines Carbanions. Die resultierende negative Ladung auf C a zu C=O wird durch die gleiche Carbonylgruppe resonanzstabilisiert.
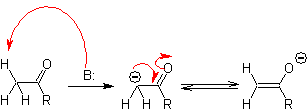
Die Auswahl der Base zur Bildung von Enolaten unterliegt der Tatsache, dass der pKa-Wert der konjugierten Säure der Base um mindestens drei Einheiten größer sein muss als der pKa-Wert der Carbonylverbindung, die saure H 's aufweist .
| pKa = 20 | MeO- pKa = 15 | Ungünstige Enolatbildung |
| pKa = 10 | tBuO- _ pKa = 19 | Sehr günstige Enolatbildung |
Bildung von Enolaten:
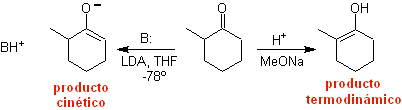
¨ Das kinetische Enolat
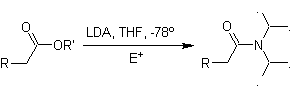
Es tritt auf, weil das Substrat über H α verfügt, das für die Deprotonierung durch eine typische Base wie LDA (pKa
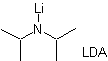
ca 30) LDA (Lithiumdiisopropylamid) ist eine starke, nicht nukleophile, sterisch gehinderte Base. |
|
¨
Enolate von Estern:
Ester sind anfällig für eine Substitutionsreaktion für die Base, LDA kann problematisch sein, weshalb bei Estern die nicht nukleophile Base (Lithiumisopropylcyclohexylamid) verwendet wird.
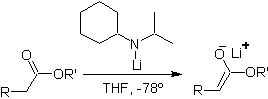
¨
Thermodynamisches Enolat:
Eine reversible Deprotonierung kann zu stabileren Enolaten führen, was auftritt, wenn das stärker substituierte C=C der Enolform erhalten wird.
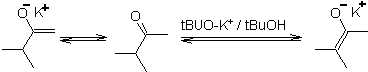
Typische Bedingungen zur Bildung thermodynamischer Enolate sind: RO-M+ in ROH als protisches Lösungsmittel (pKa von ROH = 15 bis 18).
Kinetische und thermodynamische Enolate können eingefangen, isoliert, getrennt und gereinigt werden, um regiochemisch reine Enolate zu erhalten. Dies kann durch die Bildung von Enol- und Silylenetheracetaten erreicht werden.
¨ Enolacetat:
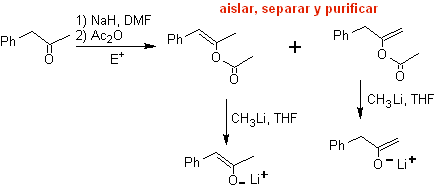
¨
Silylenether:
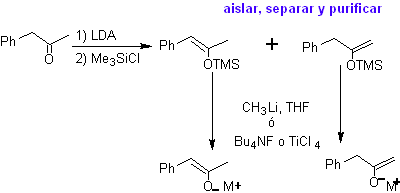
¨
Enolate aus Enonen:
Das Enolat wird durch Reduktion aus der Auflösung eines Metalls in flüssigem Ammoniak erzeugt.
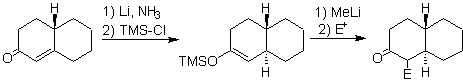
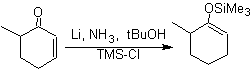
¨ Enolate aus der konjugierten Addition (1,4) in a , b – ungesättigte Ketonverbindungen
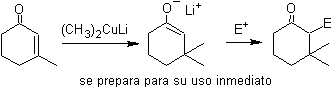
¨ Enolate aus der Reduktion von a -Halogencarbonylen
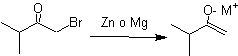
¨
Enolate aus a , b ungesättigten Ketonen
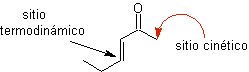
synthetische Äquivalente
Die Bildung der angegebenen synthetischen Äquivalente des Enols erfolgt durch einfache Reaktionen mit hoher Ausbeute:
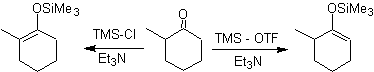
![]() Bildung der Silylenolether:
Bildung der Silylenolether:
Auch Silylenolderivate lassen sich leicht aus Estern und Amiden herstellen.
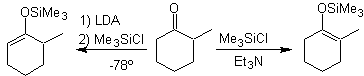
Bei Aldehyden sind vorzugsweise Silylenolether einzusetzen, da diese mit starken Basen enolisieren und eine Aldolkondensation induzieren.
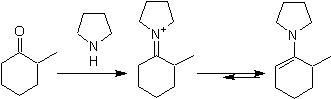
![]() Enaminbildung:
Enaminbildung:
Die Regioselektivität kann durch die geeignete Kombination elektronischer und sterischer Effekte gesteuert werden.
![]() Bildung von Enolethern durch Birch-Reduktion:
Bildung von Enolethern durch Birch-Reduktion:
Die Regioselektivität der Reduktion wird durch elektronische Effekte gesteuert.