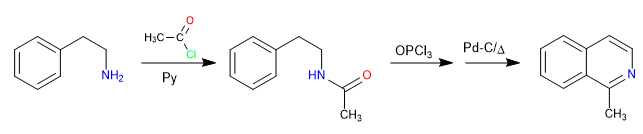
Die Reaktion zwischen 2-Aminoethylbenzol und einem Alkanoylhalogenid in Gegenwart von Pyridin bildet ein Amid. Das Amid wird durch Reaktion mit Phosphoroxytrichlorid in das Vilsmeier-Elektrophil umgewandelt. Die Cyclisierung wird durch den Angriff des Benzols auf das Elektrophil bewirkt. Eine abschließende Oxidation erzeugt Isochinolin.
Mechanismus:
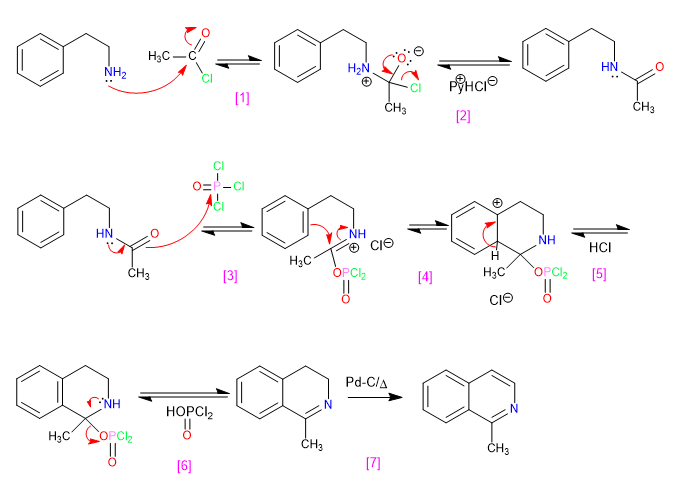
[1] Nucleophile Addition an Säurehalogenid
[2 ] Abspaltung von Chlorwasserstoff
[3] Greift Phosphoroxytrichlorid an
[4 ] Cyclisierung durch Angriff von Benzol auf das Elektrophil
[5] Wiederherstellung der Aromatizität.
[6 ] Löschen
Oxidation