 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA DE ENOLES Y ENOLATOS
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 50327
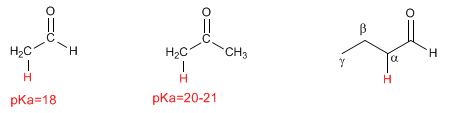
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 39264
La Ciclohexanona se convierte en 2-Metilciclhexanona por tratamiento con LDA seguido de yoduro de metilo.
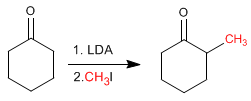
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 24836
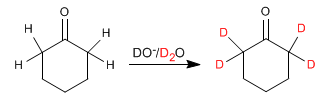
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 68467
Halogenación de la propanona en medio ácido:
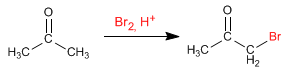
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 139927
Las cetonas metílicas [1 ] reaccionan con halógenos en medios básicos generando carboxilatos [2 ] y haloformo [3 ].
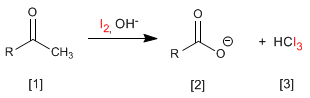
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 156813
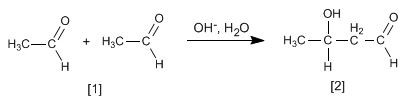
El aldol [2] formado deshidrata en el medio básico por calentamiento para formar un a,b-insaturado [3].
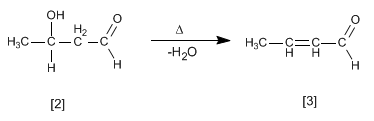
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 65557
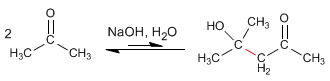
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 57007
Así, la 2,6-heptanodiona condensa con metóxido en metanol para formar el 3-metilciclohex-2-enona.
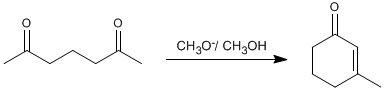
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 99941
La reacción entre dos carbonilos diferentes se llama aldólica cruzada o mixta. Esta reacción sólo tiene utilidad sintética en dos casos:
1. Sólo uno de los carbonilos puede formar enolatos.
2. Uno de los carbonilos es mucho más reactivo que el otro.
En el resto de situaciones la aldólica mixta genera mezclas de cuatro productos. Veamos como ejemplo la condensación del etanal y propanal.
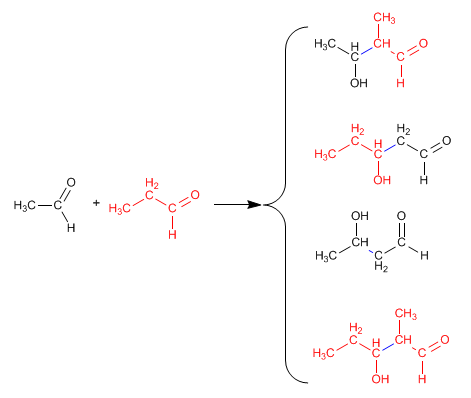
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 89575
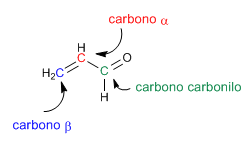 Los carbonilos a,b-insturados son compuestos orgánicos que tienen un doble enlace entre las posiciones a,b de un aldehído o cetona.
Los carbonilos a,b-insturados son compuestos orgánicos que tienen un doble enlace entre las posiciones a,b de un aldehído o cetona.
El propenal o acroleina es un carbonilo a,b-insaturado. Sus dos dobles enlaces conjugados le confieren una reactividad especial.
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 63111
Los a,b-insaturados son compuestos que poseen dos posiciones electrófilas: el carbono carbonilo y el carbono b.
Adiciones 1,2. Los organometálicos de litio atacan al carbono carbonilo dando lugar a adiciones 1,2.
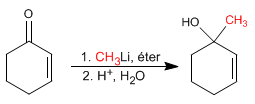
{nota} Los organometálicos de litio y magnesio atacan al carbono carbonilo de los a,b-insaturados{/nota}
- Detalles
- Germán Fernández
- TEORÍA DE ENOLES Y ENOLATOS
- Visto: 70760
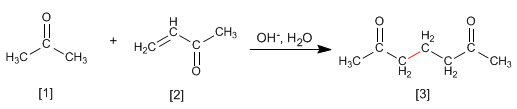
La propanona [1] reacciona con el a,b-insaturado [2] para formar el 1,5-dicarbonilo [3]