¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA DE CICLOALCANOS
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 6743
Nomenclatura de cicloalcanos
Los cicloalcanos se nombran con el prefijo ciclo- seguido del nombre del alcano con igual número de carbonos. Los cicloalcanos presentan isomería cis/trans. Cuando los sustituyentes se encuentran por la misma cara de la molécula, se dice que están cis; cuando se encuentran por caras opuestas, se dice que están trans.
Propiedades físicas
Presentan mayores puntos de fusión y ebullición que los correspondientes alcanos de igual número de carbonos. La rigidez del anillo permite un mayor número de interacciones intermoleculares, que es necesario romper mediate la aportación de energía, para pasar las moléculas a fase gas.
Tensión anular
Los cicloalcanos de pequeño tamaño (ciclopropano, ciclobutano) presentan una tensión importante debida a los ángulos de enlace y a los eclipsamientos. Los cicloalcanos de mayor tamaño como ciclopentano y ciclohexano están casi libres de tensión.
Isómeros conformacionales en el ciclohexano
El ciclohexano se dispone en forma de silla para evitar los eclipsamientos entre hidrógenos. La forma de silla del ciclohexano contiene dos tipos de hidrógenos; los axiales que se sitúan perpendiculares al plano de la molécula y los ecuatoriales colocados en el mismo plano.
Equilibrio ecuatorial-axial en ciclohexanos sustituidos
El ciclohexano presenta un equilibrio conformacional que interconvierte los hidrógenos ecuatoriales en axiales y viceversa. Cuando un ciclohexano está sustituido la conformación que más grupos sitúa en posición ecuatorial es la más estable, encontrándose el equilibrio conformacional desplazado hacia dicha conformación.
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 308281
Los cicloalcanos son alcanos que tienen los extremos de la cadena unidos, formando un ciclo. Tienen dos hidrógenos menos que el alcano del que derivan, por ello su fórmula molecular es CnH2n. Se nombran utilizando el prefijo ciclo seguido del nombre del alcano.
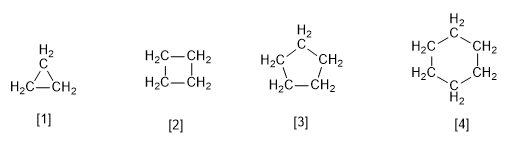
[1 ] Ciclopropano
[2 ] Ciclobutano
[3 ] Ciclopentano
[4 ] Ciclohexano
Es frecuente representar las moléculas indicando sólo su esqueleto. Cada vértice representa un carbono unido a dos hidrógenos.
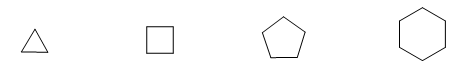
Las reglas IUPAC para nombrar cicloalcanos son muy similares a las estudiadas en los alcanos.
Regla 1.- En cicloalcanos con un solo sustituyente, se toma el ciclo como cadena principal de la molécula. Es innecesaria la numeración del ciclo.
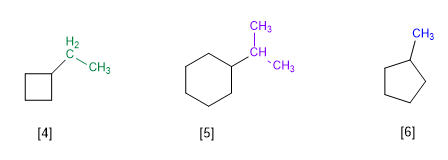
[4 ] Etilciclobutano
[5 ] Isopropilciclohexano
[6 ] Metilciclopentano
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 109332
En la naturaleza son muy abundantes los compuestos con ciclos de cinco y seis eslabones. Sin embargo, los ciclos de tres y cuatro miembros aparecen muy rara vez en productos naturales.
Estabilidad en cicloalcanos
Estos hechos experimentales sugieren la mayor estabilidad de los ciclos de cinco o seis miembros con respecto a los de tres o cuatro.
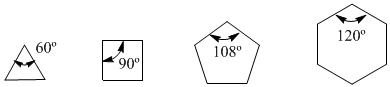
En el año 1885, el químico alemán Adolf von Baeyer propuso que la inestabilidad de los ciclos pequeños era debida a la tensión de los ángulos de enlace. Los carbonos sp3 tienen unos ángulos de enlace naturales de 109,5º, en el ciclopropano estos ángulos son de 60º, lo que supone una desviación de 49,5º. Esta desviación se traduce en tensión, que provoca inestabilidad en la molécula.
El ciclobutano es más estable puesto que sus ángulos de enlace son de 90º y la desviación es de sólo 19,5º. Baeyer aplicó este razonamiento al resto de cicloalcanos y predijo que el ciclopentano debería ser más estable que el ciclohexano.
Tensión angular
Obsérvense los ángulos de enlace de los diferentes cicloalcanos:
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 86637
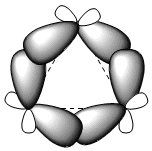 Los tres átomos de carbono del ciclopropano se sitúan en el mismo plano, a diferencia del resto de cicloalcanos que no son planos. El ciclopropano se caracteriza por una gran tensión angular debida a ángulos de enlace muy inferiores a 109,5º. La enorme tensión a la que está sometido el ciclo hace que los enlaces carbono-carbono se curven hacia el exterior, dando lugar a unos enlaces muy característicos llamados enlaces "banana".
Los tres átomos de carbono del ciclopropano se sitúan en el mismo plano, a diferencia del resto de cicloalcanos que no son planos. El ciclopropano se caracteriza por una gran tensión angular debida a ángulos de enlace muy inferiores a 109,5º. La enorme tensión a la que está sometido el ciclo hace que los enlaces carbono-carbono se curven hacia el exterior, dando lugar a unos enlaces muy característicos llamados enlaces "banana".
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 80359
El ciclobutano no es plano, uno de sus carbonos sale unos 25º del plano formado por los otros tres carbonos. Esta disposición aumenta la tensión angular, pero se reducen considerablemente los eclipsamientos hidrogeno-hidrógeno que presenta la molécula en su forma plana.
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 60275
Si el ciclopentano fuera plano, estaría prácticamente libre de tensión angular. Pero presentaría cinco hidrógenos eclipsados por cada cara, que desestabilizarían la molécula. La disposición más favorable del ciclopentano es la forma de sobre. En esta disposición la suma de tensiones angulares y eclipsamientos se hace mínima.
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 89168
 Los ciclos de seis son los más abundantes en la naturaleza. Existen multitud de compuestos con actividad biológica cuya base son ciclos de seis átomos condensados (colesterol).
Los ciclos de seis son los más abundantes en la naturaleza. Existen multitud de compuestos con actividad biológica cuya base son ciclos de seis átomos condensados (colesterol).
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 96973
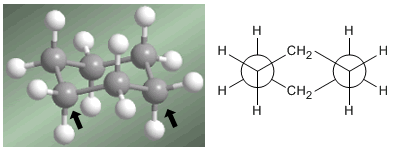
El profesor Odd Hassel de la Universidad de Oslo, estableció que la conformación más estable del ciclohexano es la forma de silla. Con ángulos de enlace de 111º la silla está casi libre de tensión angular. Además, todos los enlaces están alternados como puede observarse en la proyección de Newman.
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 9594
El ciclohexano presenta un equilibrio conformacional en el que los hidrógenos axiales, en rojo, pasan a la posición ecuatorial. Los hidrógenos ecuatoriales, en verde, pasan a su vez a la posición axial.
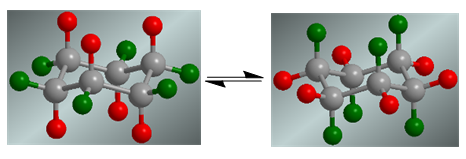
En ausencia de sustituyentes ambas conformaciones tienen la misma probabilidad de existir y el equilibrio coformacional no se encuentra desplazado.
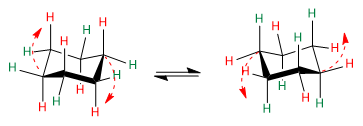
Observe las flechas rojas para comprender como tiene lugar el paso de una conformación a otra.
- Detalles
- Germán Fernández
- TEORÍA DE CICLOALCANOS
- Visto: 16838
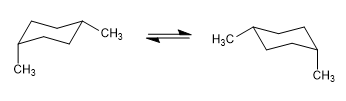
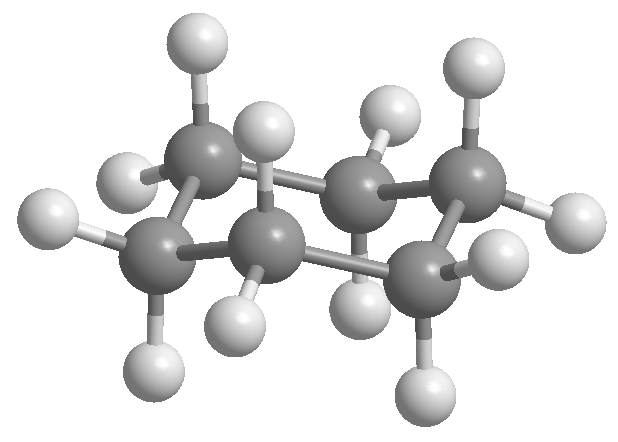
En el siguiente modelo se puede apreciar que en el confórmero ecuatorial el grupo metilo se encuentra alejado del resto de grupos. Por el contrario en el confórmero axial dicho grupo metilo se encuentra enfrentado a los hidrógenos axiales que están situados en posición 3 respecto a él. Esta proximidad espacial provoca una repulsión estérica, denominada interacción 1,3-diaxial.
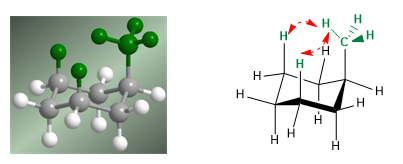
La interacción 1,3-diaxial provoca un desplazamiento del equilibrio conformacional hacia la izquierda. La conformación de la derecha presenta una energía elevada debido a la repulsión entre el metilo y los hidrógenos axiales.
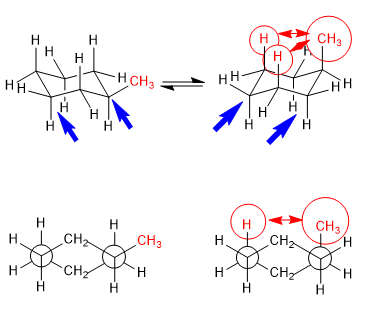
Equilibrio en el trans-1,4-dimetilciclohexano
Las interacciones 1,3-diaxiales hacen que los sustituyentes tiendan a situarse en posiciones ecuatoriales. Así en el trans-1,4-Dimetilciclohexano la conformación con los dos grupos metilo en ecuatorial es más estable que la silla que tiene los metilos axiales, esto produce un desplazamiento del equilibrio conformacional hacia la izquierda.
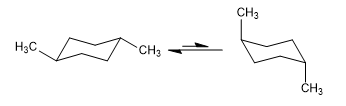
Equilibrio en el cis-1,4-dimetilciclohexano