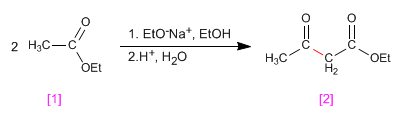¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA DE ÉSTERES
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 289173
Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno.
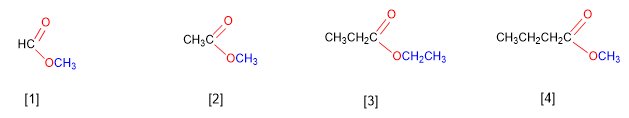
[1 ] Metanoato de metilo
[2 ] Etanoato de metilo
[3 ] Propanoato de etilo
[4 ] Butanoato de metilo
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 127906
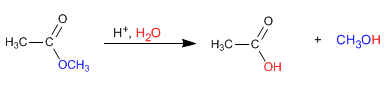
Los ésteres se hidrolizan en medios acuosos, bajo catálisis ácida o básica, para rendir ácidos carboxílicos y alcoholes.
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 134122
Los ésteres se hidrolizan en medios acuosos, bajo catálisis ácida o básica, para rendir ácidos carboxílicos y alcoholes. La hidrólisis básica recibe el nombre de saponificación y transforma ésteres en carboxilatos.
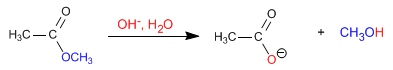
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 69783
Las lactonas son ésteres ciclicos y se hidrolizan de forma análoga a los ésteres no cíclicos, formando compuestos que contienen grupos ácido y alcohol.
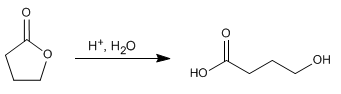
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 59824
Los ésteres reaccionan con alcoholes en medios ácidos reemplazando su grupo alcoxi por el alcohol correspondiente, como puede observarse en la siguiente reacción. Esta reacción se denomina transesterificación.
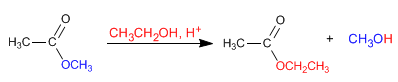
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 44049
Los ésteres transesterifican en presencia de alcóxidos, según al reacción:
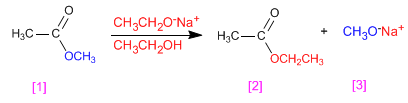
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 43800
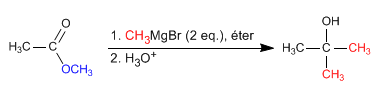
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 66683
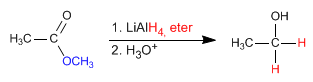
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 60402
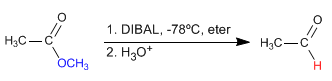
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 32663
Los ésteres tienen en su posición a hidrógenos ácidos con pKa=25, que pueden ser sustraidos empleando bases. La base conjugada es un enolato de éster, especie muy nucleófila que ataca a un variado número de electrófilos.
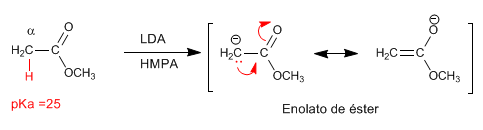
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 83683
Cuando un éster con hidrógenos a se trata con con un equivalente de base (alcóxido) condensa para formar un producto de la familia de los 3-cetoésteres. Este tipo de reacción es conocida como condensación de Claisen.