¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA DE HALUROS DE ÁCIDO
- Detalles
- Germán Fernández
- TEORÍA DE HALUROS DE ÁCIDO
- Visto: 39382
La IUPAC nombra los haluros de alcanoilo reemplazando la terminación -oico del ácido con igual número de carbonos por -oilo. Además, se sustituye la palabra ácido por el halógeno correspondiente, nombrado como sal.
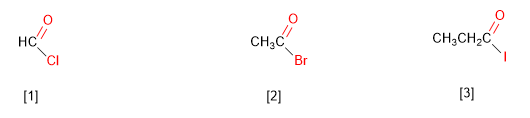
[1 ] Cloruro de metanoílo
[2 ] Bromuro de etanoílo
[3 ] Yoduro de propanoílo
- Detalles
- Germán Fernández
- TEORÍA DE HALUROS DE ÁCIDO
- Visto: 18775
Los haluros de alcanoílo reaccionan con agua a temperatura ambiente transformándose en ácidos carboxílicos.
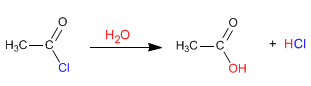
- Detalles
- Germán Fernández
- TEORÍA DE HALUROS DE ÁCIDO
- Visto: 15080
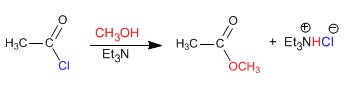
La reacción de haluros de alcanoílo con alcoholes produce ésteres. Los equilibrios de esta reacción se favorecen eliminando el ácido clorhídrico mediante una base (amina terciaria, piridina)
- Detalles
- Germán Fernández
- TEORÍA DE HALUROS DE ÁCIDO
- Visto: 24715
Las aminas y el amoniaco reaccionan con haluros de alcanoílo formando amidas. La reacción se favorece con exceso de amina, para eliminar el ácido clorhídrido desprendido en la reacción.
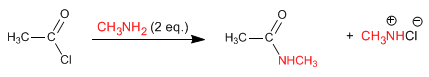
Leer más: Reacción de haluros de alcanoílo con aminas y amoniaco
- Detalles
- Germán Fernández
- TEORÍA DE HALUROS DE ÁCIDO
- Visto: 13741
Los organometálicos de magnesio a -78ºC reaccionan con haluros de alcanoílo para formar cetonas. Es necesario trabajar a temperatura baja para evitar que se adicione un segundo equivalente de organometálico, en cuyo caso el producto obtenido sería un alcohol.

Leer más: Reacción de haluros de alcanoílo con organometálicos
- Detalles
- Germán Fernández
- TEORÍA DE HALUROS DE ÁCIDO
- Visto: 20660
Los haluros de alcanoilo se reducen a alcoholes con el reductor de litio y aluminio
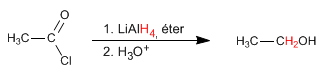
- Detalles
- Germán Fernández
- TEORÍA DE HALUROS DE ÁCIDO
- Visto: 24364
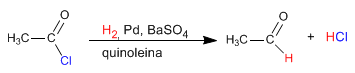
La reducción de haluros de alcanoílo se puede detener en el aldehído empleando hidruros modificados. A partir del hiduro de litio y aluminio se puede preparar el hidruro de tri(tert-butoxi)aluminio y litio. Este hidruro modificado permite redución los haluros de ácido a aldehídos.
- Detalles
- Germán Fernández
- TEORÍA DE HALUROS DE ÁCIDO
- Visto: 22977