¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA DE ÉTERES
- Detalles
- Germán Fernández
- TEORÍA DE ÉTERES
- Visto: 151099
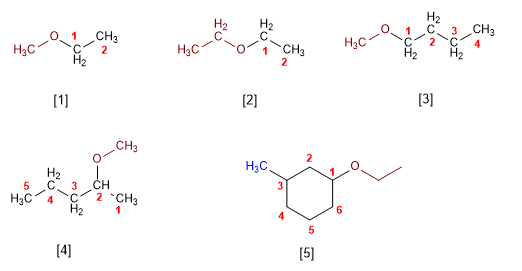
Regla 1. Los éteres pueden nombrarse como alcoxi derivados de alcanos (nomenclatura IUPAC sustitutiva). Se toma como cadena principal la de mayor longitud y se nombra el alcóxido como un sustituyente.
- Detalles
- Germán Fernández
- TEORÍA DE ÉTERES
- Visto: 91000
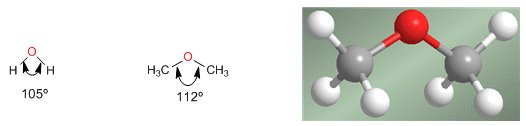
Los éteres son moléculas de estructura similar al agua y alcoholes. El ángulo entre los enlaces C-O-C es mayor que en el agua debido a las repulsiones estéricas entre grupos voluminosos.
- Detalles
- Germán Fernández
- TEORÍA DE ÉTERES
- Visto: 258325
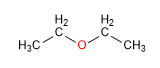
Los éteres presentan unos puntos de ebullición inferiores a los alcoholes, aunque su solubilidad en agua es similar. Dada su importante estabilidad en medios básicos, se emplean como disolventes inertes en numerosas reacciones.
- Detalles
- Germán Fernández
- TEORÍA DE ÉTERES
- Visto: 133131
- Detalles
- Germán Fernández
- TEORÍA DE ÉTERES
- Visto: 148088
La reacción entre un haloalcano primario y un alcóxido (o bien alcohol en medio básico) es el método más importante para preparar éteres. Esta reacción es conocida como síntesis de Williamson.
- Detalles
- Germán Fernández
- TEORÍA DE ÉTERES
- Visto: 18121
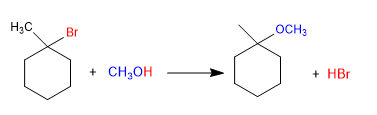
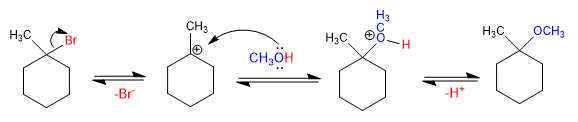
Los éteres pueden obtenerse por reacción de haloalcanos con alcoholes a través de mecanismo SN1. El haloalcano debe ser secundario o terciario para que forme carbocationes estables.
Mecanismo:
- Detalles
- Germán Fernández
- TEORÍA DE ÉTERES
- Visto: 15135
Los alcoholes se pueden proteger transformándolos en éteres. Este proceso se realiza haciendo reaccionar el alcohol que se desea proteger con tert-butanol en medio ácido sulfúrico. La desprotección tienen lugar en medio ácido acuoso. Veamos un ejemplo:
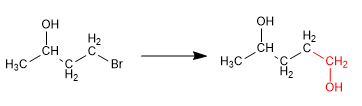
En esta síntesis es necesario formar un enlace carbono-carbono usando reactivos organometálicos, incompatibles con el alcohol. Así, se debe proteger previamente el alcohol para evitar la descomposición del organometálico.
- Detalles
- Germán Fernández
- TEORÍA DE ÉTERES
- Visto: 21256
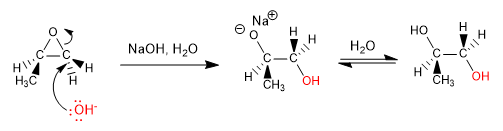
Los epóxidos (oxaciclopropanos) son éteres cíclicos de tres miembros. Su principal característica es la tensión del anillo, que favorece su apertura tanto en medios básicos como ácidos.
Apertura en medios básicos: Los epóxidos abren por ataque de nucleófilos sobre el carbono menos sustituido (la apertura se rige por impedimentos estéricos)