 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
-
Detalles
-
Germán Fernández
-
TEORÍA DE ALQUINOS
-
Visto: 112884
Como vimos en el punto anterior, los alquinos terminales presentan hidrógenos ácidos que pueden ser arrancados por bases fuertes, formando acetiluros (base conjugada del alquino). Los acetiluros son buenos nucleófilos y dan mecanismos de sustitución nucleófila con sustratos primarios.
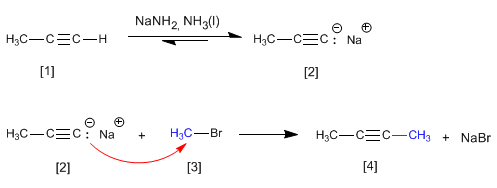
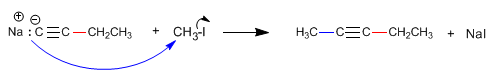
El propino [1] reacciona con amiduro de sodio en amoniaco líquido para formar el propinil sodio [2]. En la segunda etapa el propinil sodio ataca como nucleófilo al bromuro de metilo [3] para formar 2-Butino [4]. En esta reacción el alquino se alquila formándose un enlace carbono carbono que aumenta el tamaño de la cadena carbonada.
La formación de enlaces carbono-carbono es de gran importancia en síntesis orgánica, permitiendo construir moléculas de gran tamaño a partir de otras más pequeñas.
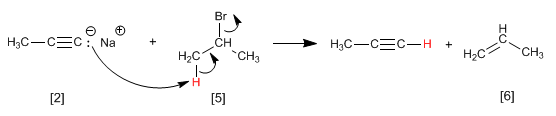
La reacción de alquilación sólo se puede realizar con haloalcanos primarios. Así, el bromuro de isopropilo [5] (sustrato secundario) genera propeno [6] por reacción con propinil sodio [2], mediante mecanismo E2
Ejemplo: Obtener 2-pentino a partir de acetileno
Paso 1. Desprotonación del acetileno con amiduro de sodio
Paso 2. Alquilación con yoduro de etilo
Paso 3. Desprotonación del 1-Butino
Paso 4. Alquilación del 1-butinil sodio con yoduro de metilo

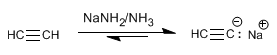
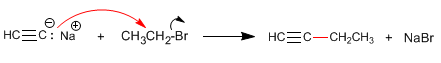
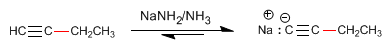
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?