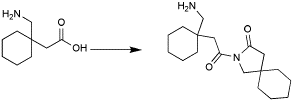
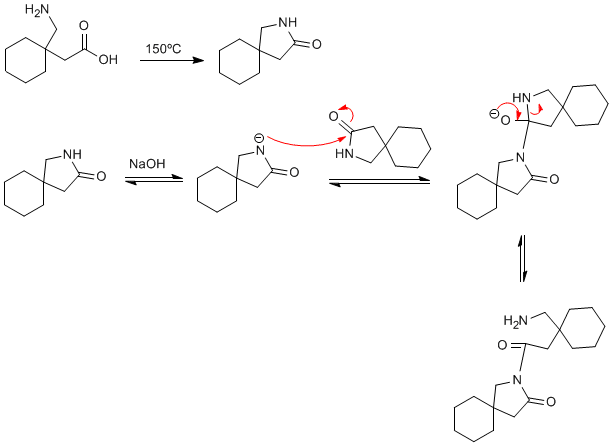
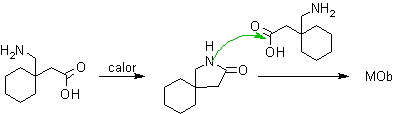
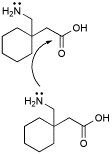
INTRAMOLECULAR CONTRA INTERMOLECULAR
En la reacción intramolecular los grupos reaccionantes están más próximos y por tanto la probabilidad de encontrarse y reaccionar será mayor. Aunque hay que tener en cuenta lo siguiente:
*El efecto de aproximación,que tiene en cuenta la aproximación o cercanía de los grupos reactivos explica experimentalmente aumentos de velocidades de reacción de (1-100).
*El efecto de orientación, que tiene en cuenta la orientación/disposición espacial de las sustancias reaccionantes,explica aumentos de velocidades de (1-100)
*El efecto de orientación de los orbitales de los átomos reaccionantes, que consiste en la orientación de los orbitales electrónicos de los grupos reaccionantes, permitiendo un solapamiento máximo entre ellos. Así pues, la orientación de orbitales puede explicar aumentos de velocidad de reacción, hasta del orden de (1-10.000.000), y que teniendo en cuenta los dos efectos anteriores el orden podría aumentar hasta (1-100.000.000.000).
O sea que en términos generales la reacción intramolecular se ve favorecida siempre y cuando cumpla con los efectos citados, pero que en \"términos generales\" repito es casi siempre más favorecida que la intermolecular. La dilución te aumentará las distancias de choques entre reactivos favoreciendo la intramolecular.