El etano es el alcano más sencillo que puede existir en diferentes conformaciones. De las infinitas conformaciones que se pueden obtener por giro del enlace carbono-carbono, destacan por su importancia las conformaciones alternada y eclipsada.
Conformación alternada del etano
Como puede observarse en la figura, la conformación alternada tiene los hidrógenos del primer carbono situados entre los hidrógenos del segundo carbono, no existen hidrógenos enfrentados.
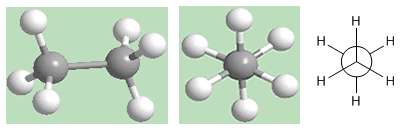
En esta conformación los enlaces carbono-hidrógeno de ambos carbonos se encuentran alejados, formando ángulos de 60º. La conformación alternada es la más estable de las conformaciones del etano. Es decir, la de menor energía.
Conformación eclipsada del etano
La segunda conformación se llama eclipsada. En ella los enlaces carbono-hidrógeno de ambos carbonos quedan enfrentados (eclipsados). Los campos electrónicos de los hidrógenos enfrentados sufren importantes repulsiones (eclipsamientos) que desestabilizan la conformación. La conformación eclipsada del etano es la de mayor energía. Es decir, la más inestable.
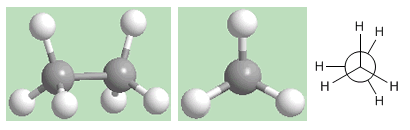
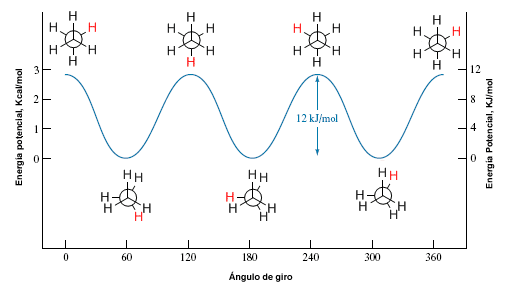
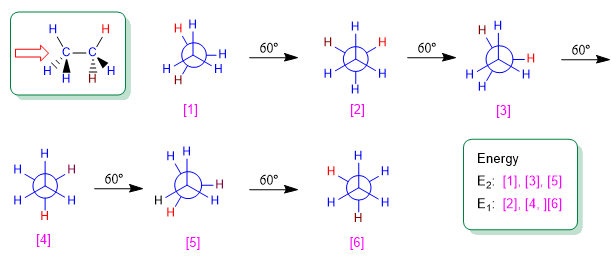
La rotación en torno a un enlace simple carbono-carbono no es completamente libre, debido a las diferencias de energía entre las conformaciones alternadas y eclipsadas. Para que la rotación tenga lugar es necesario superar una barrera energética que viene dada por la energía de la conformación eclipsada (energía de activación). En el etano esta barrera energética es pequeña, unas 2,9 Kcal/mol (12 KJ/mol), y permite que los confórmeros se interconviertan a elevada velocidad.
Diagrama de enegía potencial
Un diagrama de energía potencial nos permite entender como cambia la energía potencial del sistema durante la rotación. En estos diagramas se representa la energía potencial de la molécula frente al ángulo girado.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?