|
Welcome,
Guest
|
TOPIC:
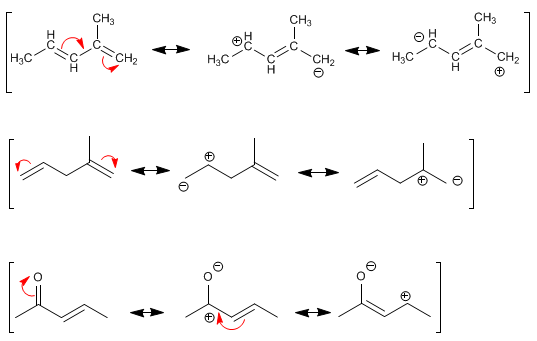
Resonancia 14 years 10 months ago #4349
|
|
Please Войти or Create an account to join the conversation. |
Re: Resonancia 14 years 10 months ago #4350
|
|
Please Войти or Create an account to join the conversation. |
Re: Resonancia 14 years 10 months ago #4351
|
|
Please Войти or Create an account to join the conversation. |
Re: Resonancia 14 years 10 months ago #4353
|
|
Please Войти or Create an account to join the conversation. |