Los nucleófilos son bases de Lewis que atacan a un carbono desplazando al grupo saliente. Es frecuente encontrar nucleófilos iónicos, pero también existen numerosos ejemplos de nucleófilos neutros. La característica general de todo nucleófilo es la presencia de pares solitarios sobre el átomo que ataca.
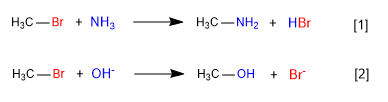
[1 ] Lenta
[2 ] Rápida
En la primera reacción el amoniaco actúa como nucleófilo -especie neutra, pero con pares solitarios sobre el nitrógeno- desplazando al bromo del carbono y formando una amina.
En la segunda reacción el ión hidróxido actúa como nucleófilo desplazando al bromo y formando un alcohol. Se observa que la primera reacción es más lenta que la segunda, en conclusión el amoniaco es peor nucleófilo que el ión hidróxido.
Se conoce como nucleofília a la capacidad de un nucleófilo para atacar a un sustrato, La nucleofilia depende de varios factores: posición del átomo atacante en la tabla periódica, carga y resonancia.
Carga - Las especies cargadas son mejores nucleófilos que las neutras
OH- >> H2O ión hidróxido (especie con carga) mejor nucleófilo que el agua (especie neutra)
NH2- >> NH3 ión amiduro (especie cargada) mejor nucleófilo que el amoniaco (especie neutra)
PH2- >> PH3 ión fosfuro (especie cargada) mejor nucleófilo que la fosfina (especie neutra)
Posición en la tabla periódica - La nucleofília aumenta al bajar en la tabla periódica y al movernos a la izquierda.
NH3 > H2O el amoniaco es mejor nucleófilo que el agua por estar más a la izquierda el nitrógeno que el oxígeno
I- > Cl- el yoduro es mejor nucleófilo que el cloruro por estar más abajo.
PH3 > NH3 la fosfina es mejor nucleófilo que el amoniaco por estar el fósforo más abajo que el nitrógeno.
Resonancia - La resonancia disminuye la nucleofilia. La deslocalización de los pares solitarios disminuyen la capacidad de ataque del nucleófilo.
OH- > CH3COO- El ión acetato es peor nucleófilo que el ión hidróxido debido a la deslocalización de la carga sobre ambos oxígenos.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?