¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA DE PIRROL, TIOFENO Y FURANO
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 16467
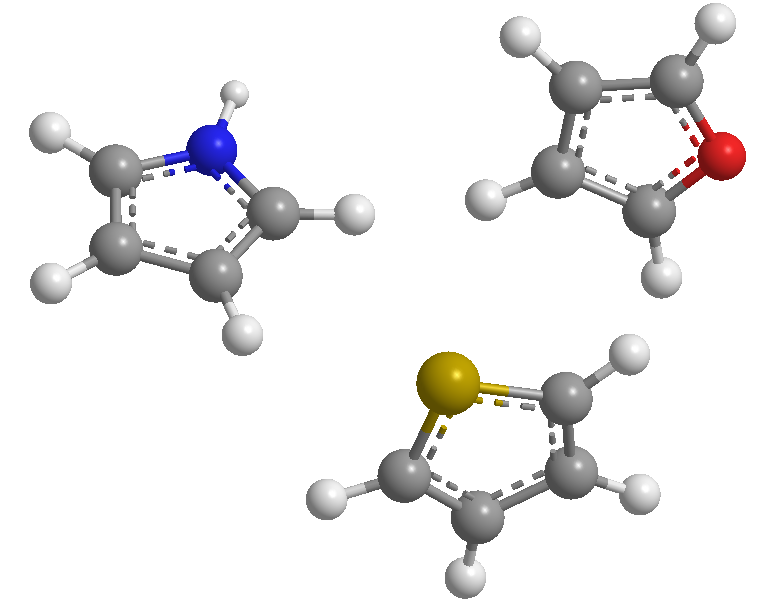
Se trata de heterociclos de 5 miembros cuyos heteroátomos son nitrógeno, azufre y oxígeno. Son sistemas aromáticos (cumplen la regla de Hückel), siendo el tiofeno el que presenta la mayor energía de estabilización (más aromático), le sigue el pirrol, siendo el menos aromático el furano debido a la fuerte electronegatividad del oxígeno que dificulta la deslocalización de la nube electrónica.
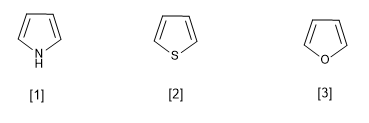
[1 ] Pirrol
[2 ] Tiofeno
[3 ] Furano
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 30647
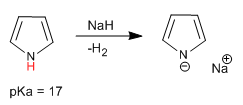
El pirrol presenta un hidrógeno ácido sobre el átomo de nitrógeno con pKa = 17. En el caso del tiofeno y furano los hidrógenos ácidos se localizan en la posición 2, aunque presentan una acidez muy inferior a la del pirrol.
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 18921
De los tres heterociclos estudiados en este tema, el pirrol es el más reactivo en la sustitución electrófila. En medios ácidos polimeriza, nitra en presencia de ácido nítrico y anhídrido acético, sulfóna con el complejo piridina-SO3, halogena en presencia de disoluciones diluidas de halógenos a temperatura baja y da las reacciones de Vilsmeier y Mannich.
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 18274
El Pirrol se nitra con nitrico en anhídrido acético ya que la mezcla sulfonítrica produce polimerización.
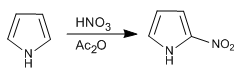
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 18751
a) Halogenación del pirrol
Para evitar polihalogenaciones debe trabajarse con el halógeno diluido y a temperatura baja. Otra opción consiste en el uso de NBS o NCS.
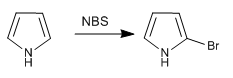
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 27914
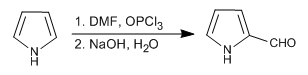
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 17066
La reacción de Mannich permite colocar el grupo aminometil sobre la posición 2 del pirrol.
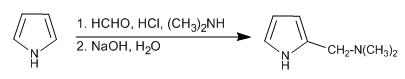
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 13316
Es posible adicionar electrófilos a la posición 3,4 del pirrol colocando grupos voluminosos sobre el átomo de nitrógeno, de modo que se impidan las posiciones 2,5. Uno de los grupos más utilizados el el triisopropilsililo.
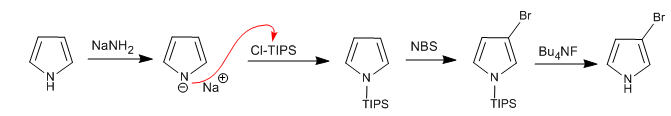
Leer más: Sustitución electrófila en la posición 3 del pirrol utilizando Cl-TIPS
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 16027
El furano nitra con ácido nítrico en anhídrido acético, sin embargo, debido a su escasa aromaticidad es atacado por los nucleófilos del medio a su posición 5 y requiere una etapa final de tratamiento básico o calefacción para recuperar la aromaticidad.
Etapa 1. Generación del electrófio
![]()
Etapa 2. Ataque nucleófilo del furano al acetato de nitronio
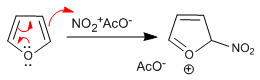
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 16105
Aunque es menos reactivo que el pirrol en la SE, sigue teniendo problemas con las polihalogenaciones, por lo que se require emplar los halógenos diluidos y a temperatura baja. También pueden emplearse NBS y NCS.
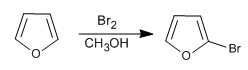
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 7765
a) Sulfonación del furano:
El furano sulfona con el complejo SO3-Py
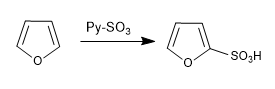
d) Formilación de Vilsmeier
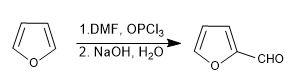
Leer más: Sulfonación, formilación, Mannich y acetilación del furano
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 6347
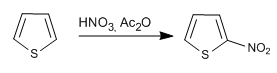
Los reactivos y condiciones de reacción son similares a los emplados en el pirrol.
a) Nitración del tiofeno
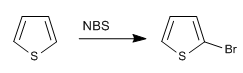
b) Halogenación del tiofeno
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 5286
Pirrol, tiofeno y furano no son atacados por nucleófilos debido a la fuerte densidad electrónica que presenta el anillo (sistemas p excentes). Por ello, no se observan reacciones de adición nucleófila, características de los sistemas p deficientes como piridina, quinolina e isoquinolina.
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 7249
La imposibilidad de estabilizar el intermedio formado después del ataque nucleófilo hace imposible esta reacción en los heterociclos de 5 miembros. Sin embargo, la presencia de grupos desactivantes unidos al anillo pueden suplir esta carencia, permitiendo la reacción.
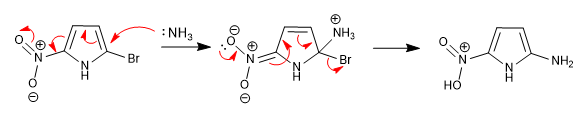
El nitro situado en posición 5 permite la deslocalización de la carga generada durante la etapa de adición.
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 6302
La reacción de heterociclos halogenados con organometálicos de litio produce el intercambio del halógeno por el metal, generándose un nuevo organometálico que permite atacar a gran variedad de electrófilos.
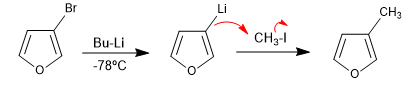
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 6391
La escasa aromaticidad del furano le permite participar en reacciones que destruyen la conjugación del anillo, como son: Diels-Alder, 1,3-dipolares, fotoquímicas y quelotrópicas.
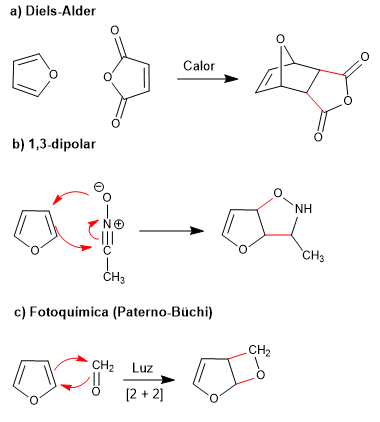
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 6437
a) Grupo saliente en posición vecina al anillo
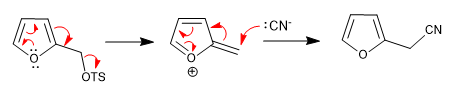
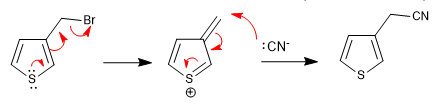
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 5709
El furano abre en medios ácidos acuosos para formar 1,4-dicarbonilos. La reacción sigue los pasos inversos a la síntesisi de Paal-Knorr.
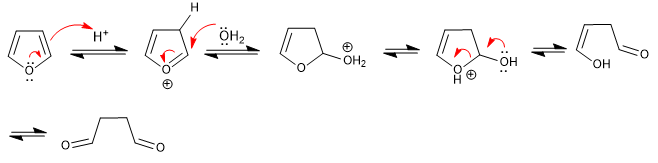
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 18138
Genera pirroles por reacción de 1,4-dicarbonilos con aminas o amoniaco.
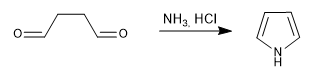
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 11689
Consiste en la reacción de una amina primaria con un 3-cetoéster formando una imina, que posteriormente tautomeriza a enamnina, atacando a una a-halocetona. En una etapa posterior de ciclación se obtiene el pirrol.
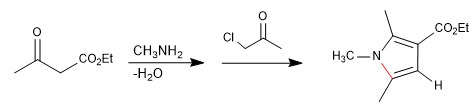
- Detalles
- Germán Fernández
- TEORÍA DE PIRROL, TIOFENO Y FURANO
- Visto: 6782
Los iluros de nitrilo reaccionan con alquinos, mediante la reacción 1,3-dipolar, para generar pirroles