¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 8873
a) Basicidad
La quinolina e isoquinolina se comportan como bases a través del par libre del nitrógeno. En medios ácidos se protonan formando sales de quinolinio e isoquinolinio.
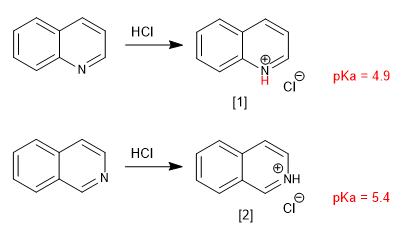
[1 ] Sal de quinolinio
[2 ] Sal de isoquiniolinio
Los sustituyentes modifican la basicidad de forma análoga a la piridina. Grupos dadores aumentan al basicidad y grupos atractores la disminuyen.
Leer más: Reacciones con par libre del nitrógeno: quinolina e isoquinolina
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 9099
La quinolina e isoquinolina reaccionan con electrófilos a través del anillo bencénico (carbociclo), debido a su mayor riqueza electrónica, comparado con el anillo piridina. Las posiciones más favorecidas son la 5 y la 8.
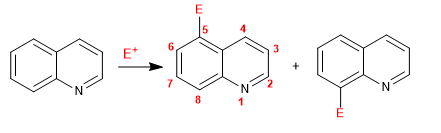
Leer más: Reacción de sustitución electrófila en quinolina e isoquinolina
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 6770
Los N-óxidos permiten colocar electrófilos en la posición 4 de la quinolina.
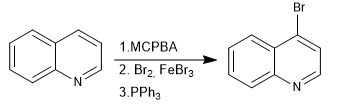
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 8160
La reacción entre derivados halogenados de quinolina e isoquinolina con organolíticos a temperatura baja, produce el intercambio del halógeno por el metal, generando nuevos organolíticos sobre el anillo.
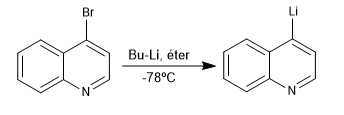
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 7049
Los nucleófilos se adicionan al carbono 2 de la quinolina, aunque en ciertas condiciones también puede recibir ataques sobre su carbono 4.
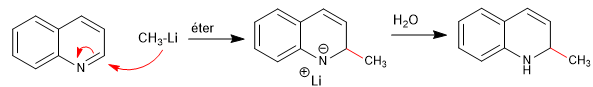
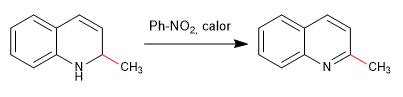
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 8470
Las quinolinas halogenadas en posición 2,4 sufren muy fácilmente reacciones de sustitución nucleófila. Por su parte la isoquinolina solo puede dar esta reacción en su posición 1. En esta reacción pueden participar todos los nucleófilos con capacidad para dar SN2, nucleófilos malos como agua o alcoholes precisan de aporte de calor.
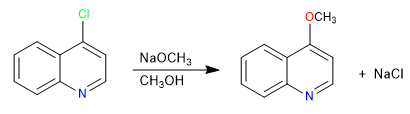
Leer más: Sustitución nucleófila en quinolina e isoquinolina
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 7488
Las piridinas con grupos alquilo en posiciones 2,4 presentan hidrógenos ácidos en el carbono vecino al anillo piridina.
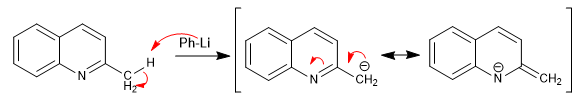
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 37891
En la síntesis de Skraup, la anilina [1 ] reacciona con carbonilos a,b-insaturados en medio ácido, para formar 1,2-dihidroquinolinas [3 ], que mediante oxidación se transforman en quinolinas [4 ]. El carbonilo a,b-insaturado puede obtenerse por deshidratación del 1,2,3-propanotrio [2 ].
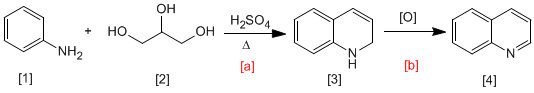
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 12485
En la síntesis de Conrad-Limpach se obtienen quinolonas por reacción de anilina con 3-cetoésteres. En condiciones cinéticas se obtiene la 4-quinolona y en condiciones termodinámicas la 2-quinolona.
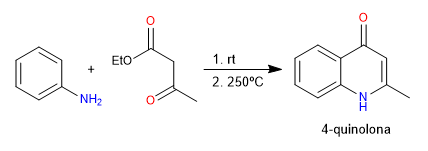
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 8165
En la síntesis de Combes se obtienen quinolinas por reacción de anilina con 1,3-dicarbonilos, en presencia de catálisis ácida. En una primera etapa se forma la imina, que tautomeriza a enamin,a activando el anillo aromático por cesión del par del nitrógeno. En la última etapa se produce la ciclación por ataque del benceno al carbonilo de la cadena
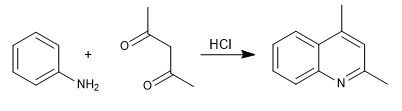
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 10174
La síntesis de Friedländer prepara quinolinas a partir de un nitrobenceno acetilado en posición orto y una cetona. La síntesis comienza con una condensación aldólica en medio básico. La reducción del grupo nitro a amino permite la ciclación por formación de imina.
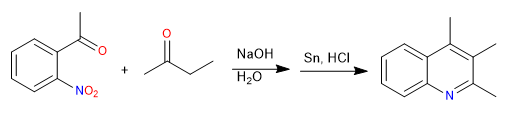
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 7091
La reacción entre el 2-aminoetilbenceno y un haluro de alcanoílo en presencia de piridina forma una amida. La amida se convierte en el electrófilo de Vilsmeier por reacción con el oxitricloruro de fósforo. Produciéndose la ciclación por ataque del benceno a dicho electrófilo. Una oxidación final genera la isoquinolina.
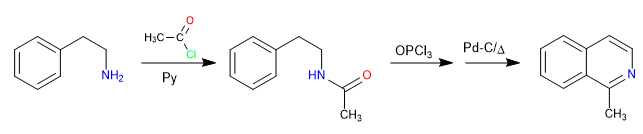
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 7909
Pictet Spengler es una reacción tipo Mannich. En la primera etapa se forma el electrófilo de Mannich por reacción de la amina con un aldehído en medio ácido clorhídrico. En la etapa final tiene lugar la ciclación por ataque del benceno al electrófilo de Mannich. La obtención de la isoquinolina se produce después de una doble oxidación.
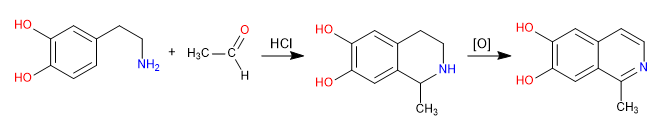
- Detalles
- Germán Fernández
- TEORÍA DE QUÍNOLINA E ISOQUINOLINA
- Visto: 7939
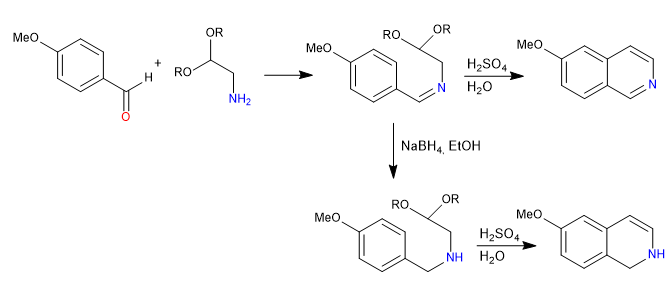
La síntesis de Pomeranz-Fritsch prepara isoquinolinas por reacción de benzaldehídos con a-aminoaldehídos protegidos en forma de acetales. En una primera etapa se forma la imina por reacción entre el benzaldehído y la amina. En un segundo paso se rompe el acetal con sulfúrico acuoso, dejando libre el aldehído que cicla por ataque del benceno.