 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA DE PIRIDINA
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 20580
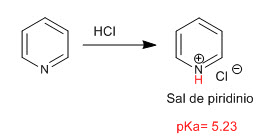
La piridina se comporta como base a través del par libre del átomo de nitrógeno. En presencia de ácidos se protona generando sales de piridinio
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 16364
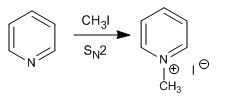
a) Reacción de alquilación
La piridina reacciona con haluros de alquilo, haluros de alcanoilo y anhídridos para formar sales de piridinio. La reacción procede mediante el ataque nucleófilo del par libre del nitrógeno sobre el carbono electrófilo de dichos reactivos.
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 14780
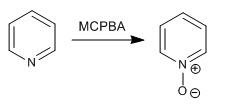
La piridina se oxida en presencia de agua oxigenada o perácidos para formar los N-óxidos de piridina.
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 28209
El anillo piridina es capaz de atacar a electrófilos, de forma análoga al benceno, dando la reacción de sustitución electrófila aromática. Debido a la electronegatividad del nitrógeno, la piridina es mucho menos reactiva que el benceno en la SE, necesitando condiciones de reacción más drásticas.
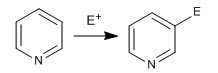
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 8301
Es posible situar electrófilos en la posición 4 de la piridina mediante la formación de N-óxidos.
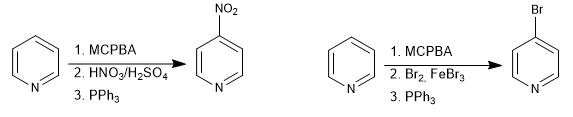
Leer más: Sustitución electrófila en la posición 4 de la piridina
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 7625
Esta reacción forma organolíticos a partir de una piridina halogenada. Los organolíticos permiten el ataque a electrófilos carbonados muy variados, como pueden ser: haluros de alquilo primarios, aldehídos, cetonas, nitrilos, ésteres, epóxidos....
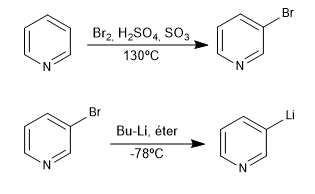
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 8770
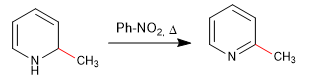
Los nucleófilos duros (organometálicos, amiduro, hidruro de litio y aluminio) atacan a la posición 2 del anillo piridina, dando lugar a reacciones de adición nucleófila. En el caso de que se produzca una etapa de oxidación final, con perdida de hidruro, puede hablarse de sustitución nucleófila.
a) Adición de organometálicos
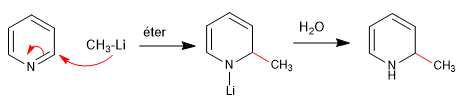
Es posible la rearomatización del anillo por adición de un oxidante que elimina "H2"
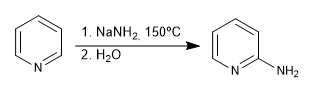
b) Adición de amiduro. Reacción de Chichibabin
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 13311
Piridinas con grupos salientes en posiciones 2,4 reaccionan con nucleófilos, produciéndose la sustitución del grupo saliente por el nucleófilo. La reacción sigue un mecanismo de adición-eliminación.
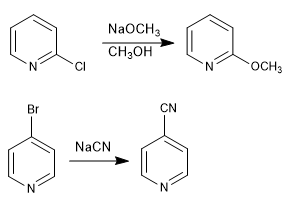
Leer más: Reacciones de sustitución nucleófila en la piridina
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 6646
Las piridinas con grupos salientes en posición 3 no dan sustituciones nucleófilas, pero pueden sufrir una eliminación en presencia de bases fuertes, que conduce a un intermedio llamado piridino (equivalente al bencino), el cual es atacado por el nucleófilo del medio.
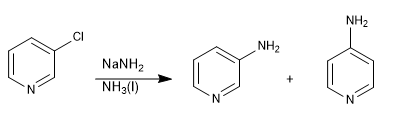
Leer más: Sustitución nucleófila por eliminación-adición: el piridino
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 6836
Las piridinas con grupos alquilo en 2,4, presentan hidrógenos ácidos en la posición vecina al anillo. Estos hidrógenos pueden sustraerse mediante el empleo de bases fuertes como tert-butillitio, LDA, etc.
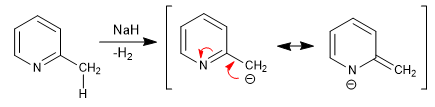
La base obtenida tiene un importante caracter nucleófilo, que permite alargar la cadena por ataque a diferentes electrófilos
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 28238
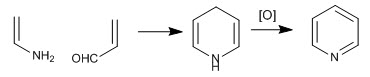
 La molécula de piridina puede obtenerse por reacción de enaminas con a,b-insaturados. Así, la reacción entre etenamina y propenal, seguida de oxidación, produce piridina.
La molécula de piridina puede obtenerse por reacción de enaminas con a,b-insaturados. Así, la reacción entre etenamina y propenal, seguida de oxidación, produce piridina.
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 15632
La condensación de dos moléculas de etanal y una de metanal produce un compuesto 1,5-dicarbonilo que reacciona con amoniaco para generar piridina.
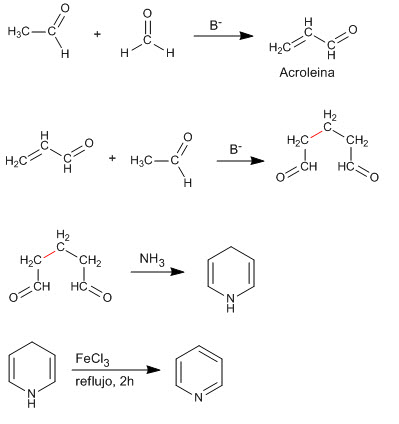
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 8252
La síntesis de Kröhnke de la piridina parte de un iluro de piridinio y un alfa,beta-insaturado para rendir el 1,5-dicarbonilo, que por reacción con amoniaco da la piridina final.
- Detalles
- Germán Fernández
- TEORÍA DE PIRIDINA
- Visto: 11491
La síntesis de Guareschi Thorpe prepara 2-piridonas a partir de cianoacetamida como componente nitrogenado, junto con una 1,3-dicetona o 3-cetoéster.