Los derivados de ácido se comportan como bases a través del oxígeno carbonílico. La basicidad de este oxígeno depende de la estabilización por resonancia del ácido conjugado.
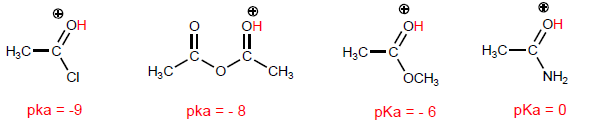
Comparemos las estructuras que estabilizan la base en el haluro y la amida.
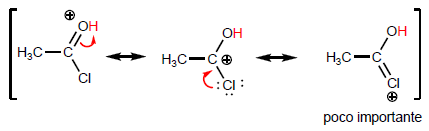
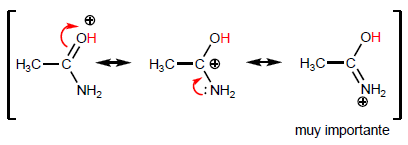
Según va tomando peso la última estructura, el ácido se vuelve más estable (débil) y por ello la base más fuerte. Las amidas son las bases más fuertes de todos los derivados de ácido.
Los derivados de ácido presentan hidrógenos ácidos en el carbono .
Los haluros de alcanoílo presentan los hidrógenos más ácidos en la posición a, mientras que las amidas tienen los menos ácidos.
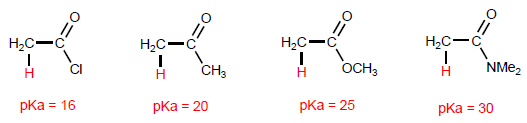
La desprotonación de la posición produce enolatos
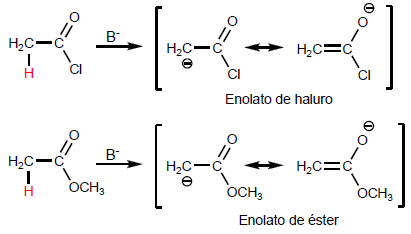
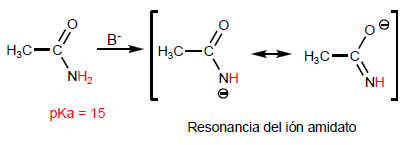
Las amidas presentan hidrógenos muy ácidos sobre el átomo de nitrógeno cuya sustracción forma amidatos.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?