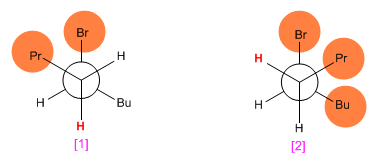
Nella reazione di eliminazione del 5-bromononano con etossido di potassio in etanolo, disegna le proiezioni di Newmann che mostrano la conformazione che porta rispettivamente al cis-4-nonene e al trans-4-nonene. Indicare l'idrogeno che si perde in ciascun caso e suggerire un meccanismo che spieghi la stereoselettività osservata.
Soluzione
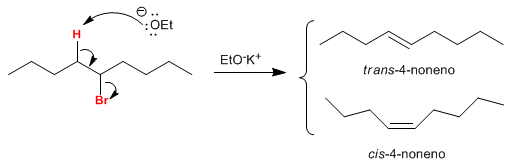
Sul carbonio b dell'aloalcano sono presenti due idrogeni che, posti in anti rispetto al gruppo uscente, generano i due isomeri. L'isomero trans si ottiene in quantità maggiore, poiché lo stato di transizione della reazione che lo forma è di minore energia.
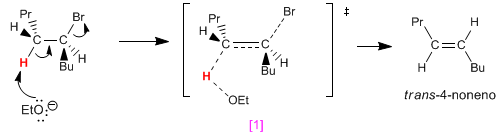
Ruotando il carbone a sinistra di 120º, posizioniamo l'idrogeno nero anti rispetto al bromo. La rimozione di questo idrogeno forma l'alchene cis.
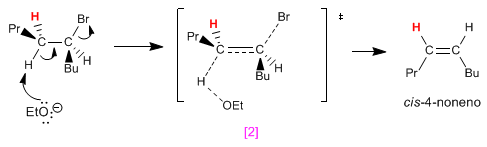
Facendo proiezioni Newmann di entrambe le conformazioni, si osserva che il [2] ha meno repulsioni (propile e butile ai lati opposti) rispetto a [1] . Questo fa sì che l'isomero trans si ottenga in quantità maggiore rispetto al cis (la reazione che forma il prodotto trans è più veloce perché ha energia di attivazione minore).