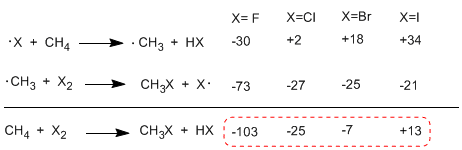Ao comparar as entalpias dos estágios de propagação dos diferentes halogênios, observam-se diferenças importantes nos calores trocados. No caso do flúor, ambas as etapas são exotérmicas (mesmo a abstração do hidrogênio) com balanço energético global de -103 Kcal/mol. As energias de ativação dos estados de transição nesta reação são muito baixas, tornando-o o halogênio mais reativo.
No outro extremo da reatividade está o iodo, cuja reação é endotérmica e não ocorre.
Ordem de reatividade F 2>Cl 2> Br 2> I 2
A tabela a seguir mostra o calor trocado nas etapas de propagação da halogenação do metano.
A reação é fortemente exotérmica no caso do flúor (halogênio mais reativo) enquanto no caso do iodo é endotérmica a 13 Kcal/mol.