¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 69573
Los aminoácidos son compuestos orgánicos que contienen las funciones ácido carboxílico y amino. Dos aminoácidos se pueden unir en condiciones adecuadas, a través de un enlace amida, formando un dipéptido. El dipéptido puede incorporar un tercer aminoácido, formando un tripéptido. Cadenas con más de 50 aminoácidos se denominan proteinas.
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 283176
Los 20 aminoácidos que forman parte de las proteínas son: Serina (Ser,S), Treonina (Thr,T), Cisteína (Cys,C), Asparagina (Asn,N), Glutamina (Gln,Q) y Tirosina (Tyr,Y), Glicina (Gly,G), Alanina (Ala,A), Valina (Val,V), Leucina (Leu,L), Isoleucina (Ile,I), Metionina (Met,M), Prolina (Pro,P), Fenilalanina (Phe,F) y Triptófano (Trp,W), Ácido aspártico (Asp,D) y Ácido glutámico (Glu,E), Lisina (Lys,K), Arginina (Arg,R) e Histidina (His,H)
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 175906
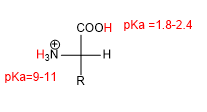 La presencia de grupos acido (-COOH) y básico (-NH2) otorga a los aminoácidos unas propiedades ácido base características.
La presencia de grupos acido (-COOH) y básico (-NH2) otorga a los aminoácidos unas propiedades ácido base características.
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 63909
Los aminoácidos se pueden obtener por halogenación de ácidos carboxílicos, seguida de sustitución nucleófila con amoniaco. La halogenación de la posición a del ácido carboxílico se realiza con la reacción de Hell-Volhard-Zelinsky.
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 54399
En esta síntesis se hace reaccionar la sal de la Ftalimida con el ester malónico halogenado. En etapas posteriores se alquila, hidroliza y descarboxila obteniéndose el aminoácido.
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 39192
Se trata de un método muy utilizado para preparar aminoácidos en el laboratorio. Se hace reaccionar el amidato de la etanamida [1 ] con el ester malónico halogenado [2 ], obteniéndose el compuesto [3 ] que se alquila e hidroliza dando un diácido [6 ], que descarboxila para formar el aminoácido [7 ].
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 64858
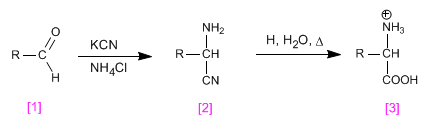
La síntesis de Strecker permite obtener aminoácidos a patir de aldehídos o cetonas.
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 35805
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 36223
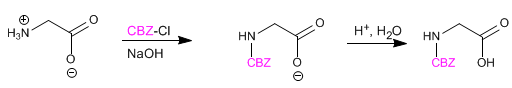
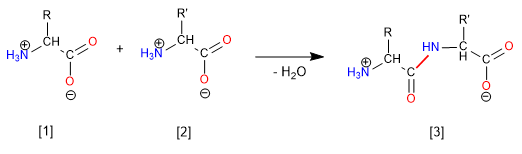
El grupo amino se protege para evitar su reacción con el grupo ácido del segundo aminoácido. Una vez formado el enlace peptídico, se realiza la desprotección, dejando libre de nuevo el grupo amino.
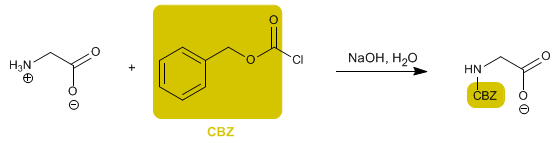
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 26654
El grupo ácido se protege tranformándolo en éster por reacción con un alcohol. Metil, etil o tert-butil ésteres se preparan por esterificación y se hidrolizan (desprotección) en medio básico.
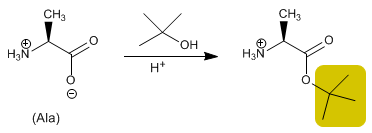
- Detalles
- Germán Fernández
- TEORÍA AMINOÁCIDOS Y PÉPTIDOS
- Visto: 61512
La síntesis del dipéptido Glicina-Alanina (Gly-Ala) tiene lugar mediante la formación del enlace amida (peptídico) entre el grupo ácido de la Glicina y el amino de la alanina. Por tanto, es necesario proteger el grupo amino de la Glicina y el ácido de la alanina.