REACCIONES EN QUÍMICA ORGÁNICA
Las reacciones orgánicas permiten la transformación de unas sustancias en otras y su conocimiento es vital en la síntesis de compuestos orgánicos. En esta sección se recopilan las reacciones orgánicas más importantes, ordenadas alfabéticamente.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 32355
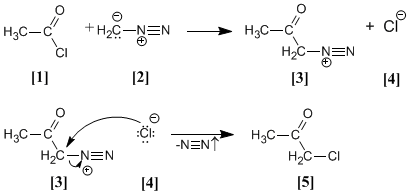
Cloruro de acetilo [1 ] se trata con diazometano [2 ] rindiendo la sal de diazonio [3 ]. El cloruro [4 ] producido reacciona con la sal de diazonio para dar la α-clorocetona [5 ].
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 22281
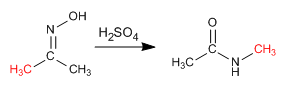
La reacción de Beckmann produce el reagrupamiento de una oxima en amida. Esta reacción se realiza en un medio ácido.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 17129
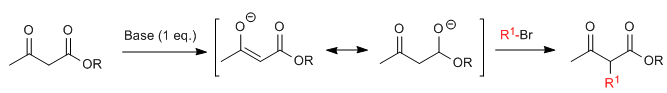
La síntesis acetilacética permite preparar cetonas mediante la C-alquilación del acetilacetato de etilo (3-oxobutanoato de etilo. El acetoacetato de etilo puede ser desprotonado en las posiciones C2 o C4 dependiendo del tipo y cantidades de base utilizados. Los hidrógenos de la posición C2 presentan una acidez importante (pKa=11) debido a estabilización de la base conjugada sobre los dos carbonilos vecinos. En presencia de un equivalente de base (alcóxidos, LDA, NaHMDS, etc.) se forma un enolato de cetoéster capaz de atacar a numerosos electrófilos carbonados.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 15177
La reacción de Blanc permite la clorometilación de compuestos aromáticos.
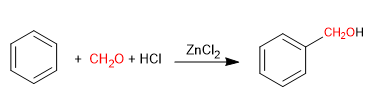
Utiliza como reactivos metanal con cloruro de hidrógeno gaseoso en presencia de un ácido de Lewis. El resultado es la introducción de un grupo hidroximetil en el anillo aromático (benceno) cuyo hidroxilo se reemplaza por cloro en presencia del cloruro de hidrógeno.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 29270
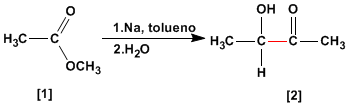
La condensación aciloínica transforma esteres [1 ] en alfa-hidroxicetonas [2 ]. Esta reacción se realiza con sodio metal en disolvente inerte.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 36324
Los aldehídos, sin hidrógenos alfa, dan la reacción de Cannizzaro por tratamiento con una base fuerte (NaOH)
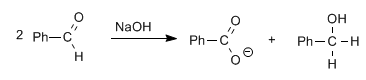
En esta reacción una molécula es reducida a alcohol, mientras que la otra es oxidada a ácido carboxílico.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 32880
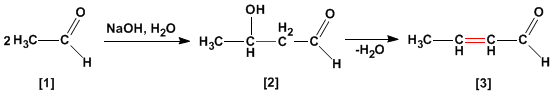
La condensación aldólica es una reacción de aldehídos o cetonas [1 ] que forma 3-hidroxicarbonilos (aldoles) [2 ]. El 3-hidroxialdehído [2 ] bajo condiciones de deshidratación por calentamiento rinde un aldehído alfa,beta-insaturado [3 ].
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 17178
La reacción de Chugaev permite la formación de olefinas a partir de xantantos.
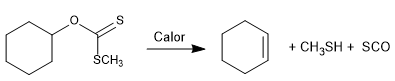
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 17592
Los ácidos y las bases catalizan la isomerización de los N-glicosidos (glicosaminas) de aldosas a 1-aminodesoxicetosas. Este reagrupamiento se puede catalizar con un variado número de ácidos de Lewis (CuCl2, MgCl2, AlCl3, SnCl4). La amina utilizada como reactivo puede ser primaria o secundaria, alifática o aromática.
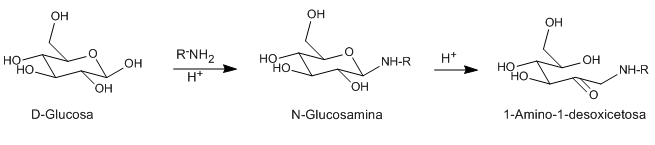
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 23149
La condensación de claisen supone la reacción de ésteres [1 ] en medio básico formando 3-cetoésteres [2 ]
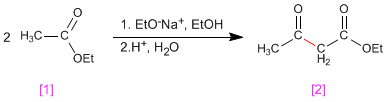
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 26481
La reacción de Abuzov se emplea en la síntesis de fosfonatos [3 ] a partir de fosfitos [1 ]. Los fosfonatos obtenidos en la síntesis de Abuzov se emplean como materiales de partida en la síntesis de Horner-Wittig.
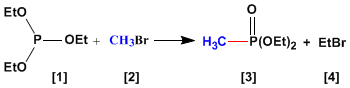
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 6961
Es la reacción entre un haluro insaturado de arilo o vinilo y un alqueno deficiente en electrones, como el acrilonitrilo o el acrilato de metilo. Emplea Paladio(0) como catalizador en presencia de una base que lo regenera.
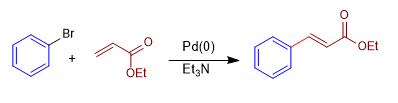
Mecanismo:
La reacción de Heck transcurre a través de un ciclo catalítico que consta de las siguientes etapas:
Etapa 1. Adición oxidante, es la etapa en la que el paladio se inserta en el enlace carbono-bromo.
Etapa 2. Carbopaladación, ataque del organometálico de paladio al carbono beta del éster a,b-insaturado.
Etapa 3. b-eliminación, formación de un doble enlace por cesión del par del enlace carbono-paladio con perdida de hidruro.
Etapa 4. Eliminación reductora, la presencia de un medio básico permite regenerar el paladio(0).
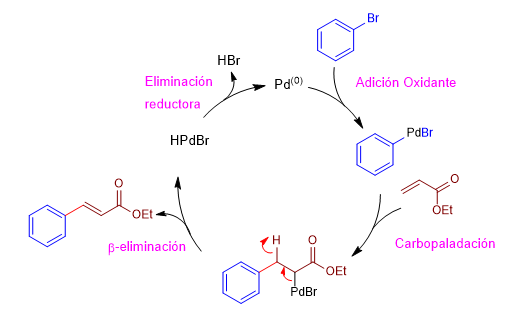
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 12388
Los reagrupamientos sigmatrópicos [3,3] de las N-alilenaminas son conocidos como reagrupamiento aza-Claisen. Esta reacción es análoga a la transposición de Claisen de los éteres alíl vinílicos.
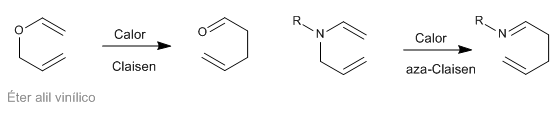
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 40248
En esta reacción dos alquenos [1 ] y [2 ] son tratados con un metal de transición que actúa como catalizador, dando una mezcla de alquenos [3 ] (incluyendo isómeros Z/E). Este productos se obtiene por intercambio de grupos alquilideno.
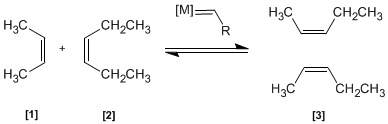
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 12835
Los 1,5-dienos isomerizan mediante reagrupamientos sigmatrópicos-[3,3] al ser calentados. Reacción conocida como transposición de Cope. El reagrupamiento de 1,5-dienos N-sustituidos recibe el nombre de transposición de aza-Cope. Dependiendo de la posición ocupada por el nitrógeno tenemos: 1-aza-, 2-aza-, 3-aza-Cope. El reagrupamiento 3-aza-Cope coincide con el aza-Claisen.
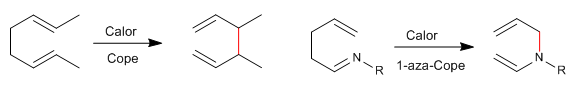
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 27436
Las tosilhidrazonas de aldehidos o cetonas [1 ] reaccionan con dos equivalentes de organolíco generando un intermedio aniónico [2 ] capaz de sufrir procesos de alquilación.
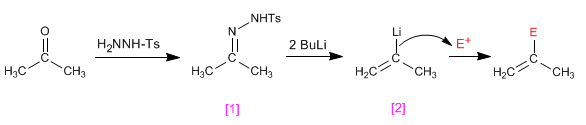
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 3417
Se llama aza-Wittig a la reacción entre un aza-iluro y un carbonilo. Los aza-iluros se preparan por reacción entre azidas y trifenilfosfina.
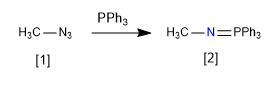
[1] Azida
[2] Aza-iluro
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 18841
La oxidación de Wacker permite transformar alquenos en las correspondientes cetonas por tratamiento con Pd en presencia de sales de cobre. El cobre tiene la capacidad de oxidar el paladio(0) a paladio(II), siendo este último el ajente catalítico de la reacción.
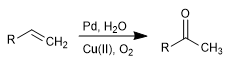
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 10621
Reacción análoga al reagrupamiento de Wittig, en el que éteres alfa metalados reagrupan a alcóxidos, generando alcoholes secundarios o terciarios después de hidrólisis. En el caso de la aza-[2,3]-Wittig se trata de aminas terciarias alílicas alfa metaladas que producen aminas secundarias después de hidrólisis.

- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 17206
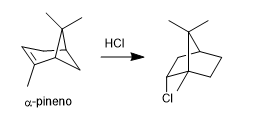
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 20907
La oxidación de Baeyer Villiger permite transformar cetonas en ésteres.
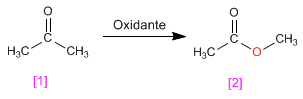
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 19779
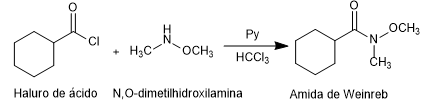
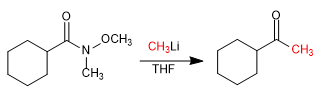
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 11165
El reagrupamiento de Baker-Venkataraman transforma orto-aciloxicetonas aromáticas en beta-dicetonas por tratamiento básico (catálisis). Las beta-dicetonas poseen un gran interés en la síntesis de cromonas, flavonas y cumarinas. Las bases más utilizadas en la reacción son: KOH, tert-butóxido de potasio, sodio en tolueno, hidruro de potasio.
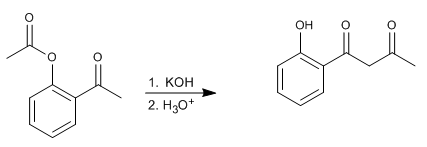
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 10467
La fragmentación de Wharton es una reacción concertada en la que un grupo saliente se sitúa en posición 4 con respecto a un grupo donor de electrones. La cesión de los pares libres del grupo donor produce la fragmentación del enlace vecino y la pérdida del grupo saliente con formación de dobles enlaces. Veamos un ejemplo:
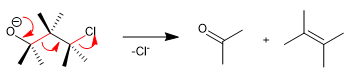
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 13787
La reacción de Schiemann consiste en la descomposición térmica de tetrafluoroboratos de diazonio aromáticos para rendir el correspondiente derivado fluorado. Aunque las sales de diazonio son intestables los tetrafluoroboratos de diazonio presentan una importante estabilidad y pueden ser preparados con buen rendimiento. El tetrafluoroborato de diazonio se prepara a partir de aminas aromáticas mediante la reacción de diazotación.
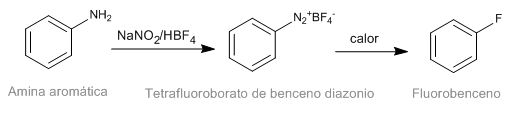
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 9779
La síntesis de Wharton permite transformar $\alpha,\beta$-epoxicetonas en alcoholes alílicos por tratamiento con hidrazina en medio ácido acético o hidrato de hidrazina seguido de base fuerte. La $\alpha,\beta$-epoxicetona se obtiene a partir de la cetona $\alpha,\beta$-insaturada por oxidación con agua oxigenada en medio básico.
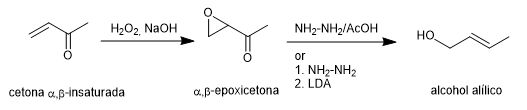
Leer más: Wharton síntesis de olefinas (Transposición de Wharton)
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 20954
Tosilhidrazonas [2 ] de aldehídos o cetonas alifáticos [1 ] reaccionan con bases fuertes para dar alquenos [3 ].
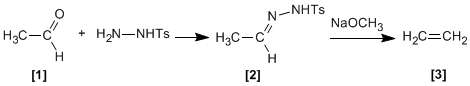
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 10743
En 1902, Wolff observó que al tratar diazoacetofenona ($\alpha$-diazocetona) con Ag2O/H2O se producía un reagrupamiento que generaba el ácido fenilacético.
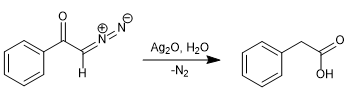
Al reemplazar el agua por amoniaco se obtiene la fenilacetamida.
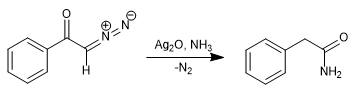
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 12263
La reacción de Barbier permite obtener reactivos organometálicos inestables en el medio de reacción. Inicialmente se llevó a cabo con Magnesio metal, generando in situ magnesianos. Posteriormente se extendió a otros metales: Sn, Zn.., pudiendo trabajar en medios acuosos, sin precisar la protección de grupos ácidos (hidroxilos)
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 23423
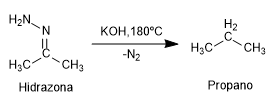
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 18779
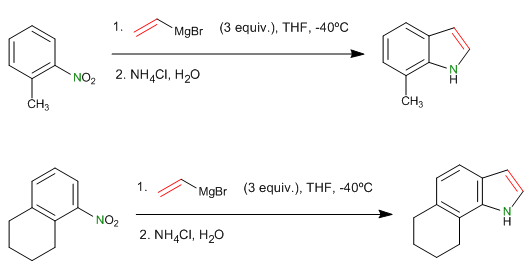
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 35976
En 1855, Wurtz trató haluros de alquilo con sodio metal obteniendo el correspondiente alcano simétrico. El acoplamiento de dos carbonos sp3 pertenecientes a haluros de alquilo o arilo por tratamiento con sodio metal se conoce como síntesis de Wurtz. Por otro lado, el acoplamiento de un haluro de alquilo con un haluro de arilo se denomina reacción de Wurtz-Fittig.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 19573
La reacción de Barton produce 4-nitrosoalcoholes [2 ] a partir de nitritos [1 ] por irradiación con luz ultravioleta.
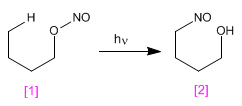
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 14287
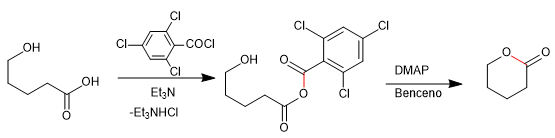
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 20037
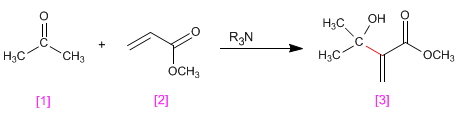
Los aldehídos y cetonas [1 ] reaccionan con compuestos a,b-insaturados [2 ] en presencia de aminas terciarias que actúan como catalizadores, para formar productos a-hidroxialquilados [3 ].