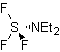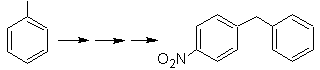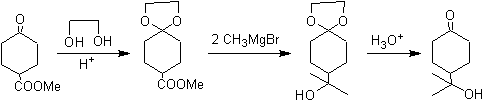SÍNTESIS ORGÁNICA
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 54430
METODOLOGÍAS DE LA SÍNTESIS ORGÁNICA
La síntesis total de un compuesto orgánico requeriría partir cada vez de los elementos que lo componen. Sin embargo, es bien sabido, que a partir de los elementos se pueden obtener compuestos orgánicos simples como la úrea, el metano, metanol, acetileno, ácido acético, etanol y así siguiendo se puede ir construyendo estructuras cada vez más complejas.
No obstante, esto no es práctico ni necesario ya que existen una gran cantidad de compuestos orgánicos que están disponibles comercialmente o son asequibles económicamente y se puede usar éstos como materiales de partida. Estrictamente hablando todos ellos derivan de los elementos que lo componente o pueden derivarse de ellos, así que cualquier síntesis que se encare a partir de esas materias primas, será “formalmente” una síntesis total.
Las metodologías de síntesis para encarar una síntesis exitosa han ido cambiando con el transcurrir del tiempo y el desarrollo de la misma química como ciencia, de ahí que se conocen, las siguientes:
- Metodología de la “asociación directa”
- Metodología de la “aproximación intermedia”
- Metodología del “análisis lógico”
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 31144
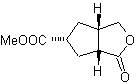
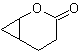
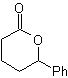
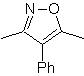
Desconexión de compuestos 1,2-dioxigenados
1.- Compuestos a-hidroxicarbonílicos
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 37715
La elaboración de un “árbol de síntesis” a base de generar moléculas intermedias o precursoras, paso a paso en dirección antitética (retrosíntesis), es decir a partir de la molécula objetivo, constituye un método que puede comprenderse mejor al considerar los siguientes principios generales de dicho proceso.
1. Comenzar con la estructura final (MOb). Partiendo de la estructura final, la molécula objetivo, se trabaja hacia atrás (retrosíntesis) hasta lograr materias primas fácilmente accesibles. Si la materia prima de partida está especificada en el problema de síntesis, esto tan sólo limita el número de posibles rutas sintéticas a ser encaradas.
2. Caracterización de la molécula objetivo (MOb). Al examinar la estructura de la molécula objetivo, es necesario responder las siguientes interrogantes:
a. ¿Qué tipo de compuesto es?
b. ¿Qué grupo (s) funcional (es) contiene?
c. ¿Cuál es la naturaleza del esqueleto carbonado?
d. ¿Tiene la molécula una cadena alquílica normal o con ramificaciones?
e. ¿Contiene anillos y son éstos cicloalquílicos o aromáticos?.
f. ¿La MOb tiene simetría real o potencial?
3. El Grupo Funcional. Sobre el particular será también bueno responder a las siguientes interrogantes:
a. ¿Es conocida la reactividad, sensibilidad e inestabilidad de los grupos funcionales que posee la MOb?
b. ¿Qué métodos generales se tiene disponibles para su preparación?
c. ¿Cuál de ellos es aplicable al grupo funcional específico de la molécula problema?
Leer más: Principios Generales del Método del Árbol de Síntesis
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 32962
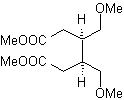
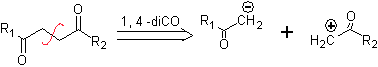
DESCONEXIÓN DE COMPUESTOS 1,4-DIOXIGENADOS
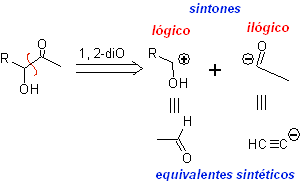
Otro grupo de compuestos de mucha importancia en la síntesis química, lo constituyen las moléculas dioxigenadas que se hallan en una relación de distancia 1,4. Estos compuestos cuando se someten a un análisis de desconexión retrosintético, generan sintones, en donde uno de ellos, el electrófilo o nucleófilo, puede ser considerado “anómalo” o “ilógico”, en razón a que la carga asignada a uno de los átomos no puede explicarse en términos de la electronegatividad intrínseca o inducida del mismo.
1. Compuestos 1,4-dioxigenados (1,4-diO)
En este tipo de compuestos, la desconexión conduce también a un sintón lógico y a otro sintón ilógico (no natural), que puede ser un nucleófilo o un electrófilo, cuyo equivalente sintético, tiene que ser todavía reelaborado adecuadamente, para poder ser utilizado en la reacción química.
1. 1. Compuestos 1,4-dicarbonílicos
1.1.1. Compuestos 1,4- dicetónicos
Las alternativas de desconexión de este tipo de compuestos o moléculas a ser sintetizadas (MOb), pueden conducir a las siguientes opciones:
a. Un sintón aniónico lógico y un sintón catiónico ilógico
El equivalente sintético del anión es el ión enolato o el mismo enol del compuesto carbonílico. En cambio el equivalente sintético para el carbocatión es el alfa halocarbonilo. (Umpoloung)
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 42030
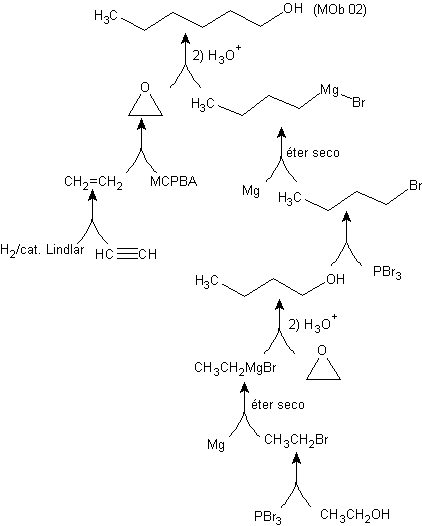
Síntesis del n-Hexanol (MOb 02)
Solución: El n-Hexanol (MOb 02) es un alcohol
primario, cuya cadena carbonada no presenta ramificaciones. Por lo tanto, la
estrategia se reduce a buscar reacciones que permitan hacer crecer la cadena en
un buen número de átomos de carbono. No es aconsejable que el crecimiento de la
cadena sea de uno en uno, ya que dicho camino conduciría a un plan de síntesis
con muchas etapas, consiguientemente un bajo rendimiento.
En tal
virtud, la apertura de anillos epóxido por un compuesto de Grignard se puede
adecuar a este propósito; como también se puede combinar con la síntesis
acetilénica (utilización de derivados del acetiluro de sodio y posterior
saturación del triple enlace).
El epóxido necesario para que se combine con el Grignard se prepara a partir de un alqueno y un ácido perácido. Así, se llega a deducir el presente plan de síntesis, donde los materiales de partida pueden ser el acetileno y el etanol.
Leer más: Problemas de síntesis, resueltos por el método del Árbol de Síntesis
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 26360
DESCONEXIÓN DE COMPUESTOS 1,6-DIOXIGENADOS
Los compuestos 1,6 difuncionalizados, preferentemente utilizan la estrategia de la reconexión para su respectiva síntesis; esta estrategia, puede muy bien combinarse con la reacción de Diels-Alder, que en general forma como producto, aductos olefínicos de seis eslabones o la reducción de Birch de anillos bencénicos, que igualmente genera productos olefínicos de seis eslabones
1. Compuestos 1,6 dioxigenados
La reacción que genera compuestos dicarbonílicos, de diferente combinación posible: dicetonas, cetoácidos, cetoaldehidos, diácidos, etc y a diferentes distancia la una de la otra, sin duda, es la reacción de ozonólisis de compuestos olefínicos.
Dependiendo de la estructura del sustrato y las condiciones de la reacción sobre el ozónido intermedio formado, se conseguirán una diversidad enorme de compuestos como resultado de la ruptura del doble enlace olefínico. De ellos, son de especial interés aquellos que se hallan en una relación 1, 6 – dioxigenada, como puede colegirse de la siguiente operación sintética de “reconexión”:
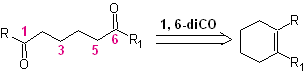
La mejor manera de comprender el funcionamiento de esta “operación sintética de reconexión”, se lo conseguirá a través de la solución de la síntesis de las siguientes moléculas orgánicas:
|
MOb 50
|
|
MOb 51
|
|
MOb 52
|
|
|
|
|
|
|
|
MOb 53
|
|
MOb 54
|
|
MOb 55
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 51123
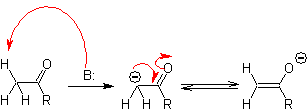
Formación de enoles y enolatos
El carbono alfa de
compuestos que contienen el grupo carbonilo (aldehídos, cetonas, ésteres,
dicetonas, diésteres, nitratos, nitrilos, etc.), es el centro de muchas
reacciones de formación de enlace C-C. Debido a la acidez de los Ha, éstos sufren una a-desprotonación en presencia de una
base adecuada, con la consiguiente formación de un carbanión. La carga negativa
resultante sobre el Ca al C=O, es
estabilizada por resonancia, por el mismo grupo carbonilo.
La selección de la base, para la formación de enolatos, se
sujeta a que el pKa del ácido conjugado de la base debe ser mayor por lo menos
en tres unidades al pKa del compuesto carbonílico que posee Ha acídicos.
|
|
pKa = 20 |
MeO- pKa
= 15 |
Formación del enolato desfavorable |
|
|
pKa = 10 |
tBuO- pKa =
19 |
Formación del enolato muy favorable |
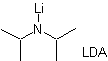
Formación de enolatos:
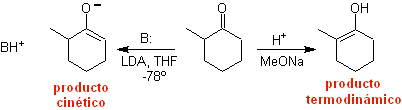
¨ El enolato cinético
|
Se da
porque el sustrato, cuenta con Hα, fácilmente accesibles para la desprotonación por medio de
una base típica como es el LDA (pKa
aprox 30)
El LDA (diisopropilamiduro de litio) es una base fuerte, no
nucleofílica, con impedimento estérico |
|
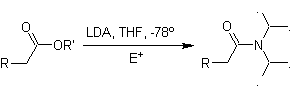
¨
Enolatos de
ésteres:
Los ésteres son susceptibles de una reacción de sustitución
por la base, el LDA puede ser
problemático, razón por la cual con los ésteres se utiliza la base no
nucleofílica (isopropilciclohexil amiduro de litio)
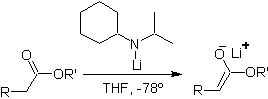
¨
Enolato
termodinámico:
Una desprotonación reversible puede conducir a enolatos más
estables, lo cual ocurre cuando se obtiene el C=C más substituido de la forma
enólica.
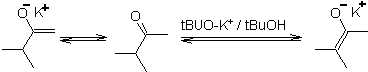
Las condiciones típicas para formar enolatos termodinámicos
son: RO-M+ en ROH como solvente prótico (pKa del ROH = 15 a18).
Los enolatos cinético y termodinámico, pueden ser atrapados,
aislados, separados y purificados, para obtener enolatos regioquímicamente
puros. Esto puede realizarse por la formación de acetatos de enol y
sililenoléter
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 30013
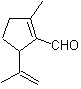
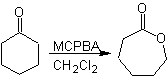
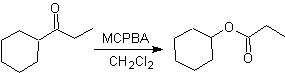
Oxidación de Baeyer–Villiger
Otra reacción que puede asociarse a la estrategia de la retrosíntesis, es la oxidación de cetonas por
peroxiácidos, mas conocida como reacción de Baeyer-Villiger. En cetonas
cíclicas, la oxidación con perácidos, genera lactonas. Los grupos unidos a las
cetonas asimétricas, poseen una aptitud migratoria, que permite, en términos
literales, “ insertar un átomo de oxigeno” entre el grupo carbonilo y el grupo
migrante, produciéndose así, un éster o una lactona.
Se debe tomar en cuenta, que las enonas (cetonas α, β
insaturadas) no son buenos sustratos para la oxidación de Baeyer-Villiger, en
razón a que el alqueno es mucho mas reactivo que la cetona. Sin embargo hay estructuras especiales donde el alqueno
puede ser protegido por un sustituyente cercano por el efecto estérico y
orientarse de este modo el ataque del peracido hacia el grupo carbonilo.
|
|
… |
|
Recuérdese que la aptitud migratoria de los diferentes
grupos, en la reacción de Baeyer-Villiger, es como sigue:
H > Ph
> alquilo 3º > cicloalquilo
> alquilo 2º > alquilo 1º > Me
Proponer un plan de síntesis para las siguientes moléculas:
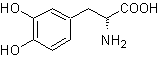
|
MOb 56
L-Dopa |
. |
MOb 57
|
. |
MOb 58
|
|
|
|
|
|
|
|
MOb 59
|
|
MOb 60
|
|
MOb 61
|
MOb 56. Análisis retrosintético.
El alfa aminoácido, de
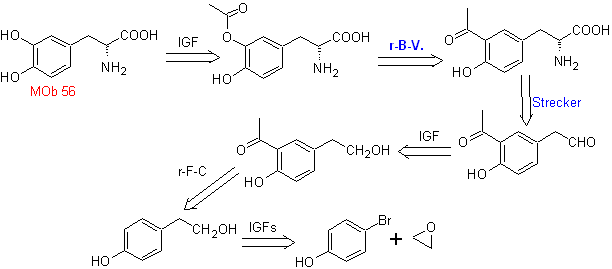
Síntesis.
Para la formación del Grignard
requerido, se protege el OH orto del benceno. La síntesis de Strecker, permite
formar el alfa aminoácido, que es oxidado de acuerdo a Baeyer-Villiger con un
perácido y el producto se somete a una hidrólisis ácida del grupo éster, lo que
conduce a la formación de
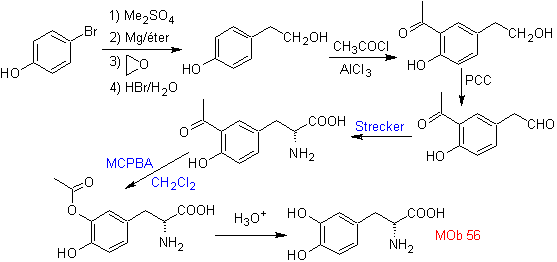
Leer más: La oxidación de Baeyer-Villiger como estrategia en la Retrosíntesis
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 56257
Reacciones de Enoles y Enolatos
Las reacciones aldólicas y las denominadas reacciones de
condensación de compuestos carbonílicos y otros de este tipo, que pueden formar estructuras enólicas
y enolatos, participan de un gran grupo de reacciones importantes que permiten comprender
la existencia de un número inmenso de moléculas producto de la interacción de
enoles o enolatos con una serie de grupos electrófilos.
El estudio de este tipo de reacciones ha permitido constatar
y establecer la existencia de dos mecanismos de reacción por los que
transcurren, como se pasa a explicar a continuación:
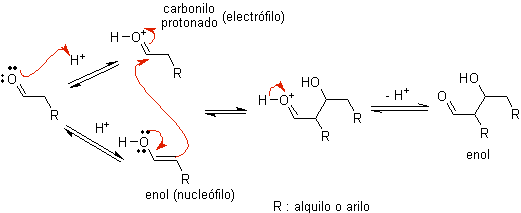
A)
Cuando se usa ácido como catalizador, inicialmente el compuesto
carbonílico se protona y luego tautomeriza a su forma enólica, que es un nucleófilo en el carbono alfa al
grupo carbonilo. El mismo medio ácido es suficiente para activar el grupo
carbonilo de otra molécula, haciéndolo altamente electrofílico, lo que genera
condiciones óptimas para producir un compuesto carbonílico insaturado.
La reacción normalmente transcurre hasta la deshidratación del enol formado, catalizado por el mismo ácido de la reacción.
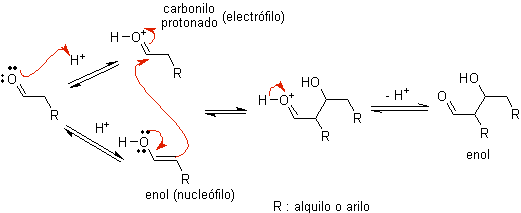
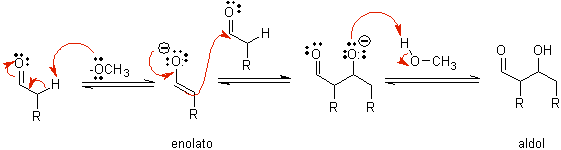
B) Cuando el catalizador es una base, como el alcóxido, la reacción del tipo
aldólico procede vía el ataque nucleofílico del enolato estabilizado por
resonancia al grupo carbonilo de otra molécula.
Por deshidratación del aldol,
catalizada por base se forma el producto final deshidratado
Como en el anterior caso, la deshidratación catalizada
por bases
(algunas veces escrita en un solo paso), permite controlar la reacción y
producir un producto final deshidratado. En algunos casos, la formación de
enolatos es irreversible.
Como se ve sólo se
requiere una cantidad catalítica de base en algunos casos, el procedimiento más
usual es usar una cantidad estequiométrica de base fuerte tal como el LDA
o NaHMDS.
En este caso, la formación de enolato es irreversible, y el producto aldólico
no se forma hasta que el alcóxido metálico del producto aldólico es protonado
en un paso posterior.
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 35554
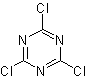
La transposición de
Beckmann como estrategia en
La transposición de oximas en medio acido, denominada
transposición de Beckman, produce una amida o lactama si la cetona de partida
es lineal o cíclica respectivamente.
Para mejorar el rendimiento de este tipo de reacciones se han
estudiado varios catalizadores y medios ácidos. Así por ejemplo, nuevos medios
ácidos utilizados como catalizadores, con el propósito indicado, lo
constituyen, el TCT/DMF, DAST/CH2CL2 , CF3SO3H,
PCl5, HgCl2/MeCN y
el ZnO.
|
TCT:
Triclorotriazina |
…… |
DAST:
Trifluoruro de
dietilaminosulfuro |
La aptitud migratoria de los grupos es la misma que en la
reacción de Baeyer – Villiger. Proponer un diseño de síntesis para cada una de
las siguientes moléculas:
|
|
MOb 62
|
|
MOb 63
|
|
MOb 64
|
MOb 62. Análisis
retrosintético.
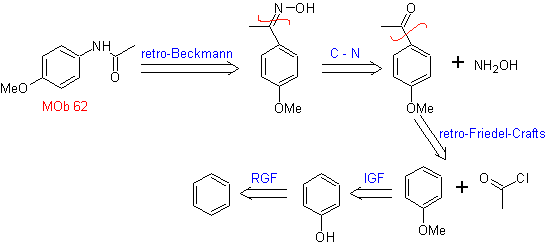
Síntesis. La reacción de la cetona aromática intermedia con NH2OH y su posterior tratamiento con una solución acuosa de ácido sulfúrico y ZnO, permite formar la amida aromática MOb 62.
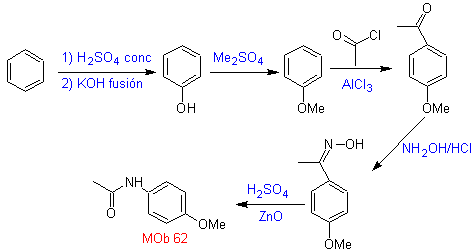
Leer más: La transposición de Beckmann como estrategia en la Retrosíntesis
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 45065
La síntesis orgánica, corazón de la química orgánica, es una actividad esencialmente heurística, es decir, es un proceso donde se fusionan las actividades creadoras del pensamiento lógico altamente predictivas y los procedimientos empíricos, ricos en elaboración artística, que hacen del químico orgánico un verdadero innovador.
Como todo método, el “método de las desconexiones o del sintón”, tiene su estructura, simbología y lenguaje propios, que inicialmente deben de ser asimilados y comprendidos, por quiénes se disponen a utilizar esta herramienta sintética.
El método de síntesis de las desconexiones o del sintón, comprende dos fases;
![]() Fase de análisis retrosintético. En él, se muestra todas las transformaciones que se realizarán en el proceso de simplificar la estructura de
Fase de análisis retrosintético. En él, se muestra todas las transformaciones que se realizarán en el proceso de simplificar la estructura de
![]() Fase de síntesis. En donde lo “pensado”, en base a criterios de racionalidad mecanística y de reactividad de los compuestos orgánicos, se concreta en una ruta de síntesis, que será escrita, tal cual se espera ocurra en el laboratorio químico. Es donde aflora la experiencia y manifiesta el “arte de hacer o inventar” del químico, es decir
Fase de síntesis. En donde lo “pensado”, en base a criterios de racionalidad mecanística y de reactividad de los compuestos orgánicos, se concreta en una ruta de síntesis, que será escrita, tal cual se espera ocurra en el laboratorio químico. Es donde aflora la experiencia y manifiesta el “arte de hacer o inventar” del químico, es decir
Los términos, definiciones u operaciones de síntesis, recurrentemente utilizados en este método, son los siguientes:
Molécula Objetivo (MOb).
Se denomina así, a toda molécula que se desea sintetizar o preparar a partir de materiales simples y asequibles, que en un problema, pueden estar previamente definidos o estar ajustados a las opciones que el químico genere en su plan o diseño de síntesis.
Transformación. (![]() ).
).
La flecha unidireccional especial de retrosíntesis, debe entenderse como una representación simbólica de la expresión “se prepara a partir de” y también representa algún tipo de transformación en la estructura de
Los tipos de transformación al que se hace referencia, en realidad son operaciones retrosintéticas como las: Desconexiones, Reconexiones, Reordenamientos, Interconversión de Grupos Funcionales (IGF), Adición de Grupos Funcionales (AGF), Supresión de Grupos Funcionales (SGF), etc.
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 24750
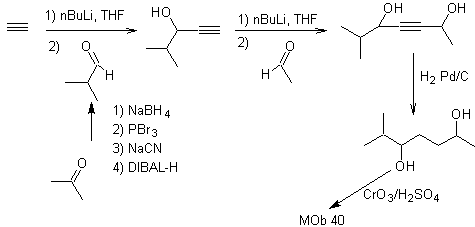
Otras estrategias de síntesis
que utilizan sintones “ilógicos”
1.
Adición de triple enlace
La estrategia de "adicionar" un triple enlace, entre
dos funciones oxigenadas en posición 1,4, permite trabajar posteriormente con una desconexión
basada en la química de los acetiluros. Con el fín de ejemplificar esta estrategia, veamos la e laboración de un plan de
síntesis para
MOb.
40. Análisis
retrosintético. Una primera IGF en
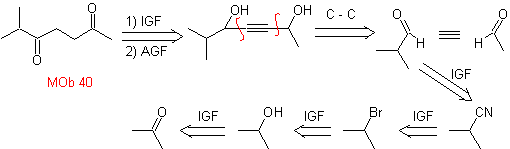
Síntesis. El diacetiluro o
acetiluro por etapas, se combina con moléculas de aldehídos diferentes, se hidrogenan la
molécula intermedia formada y seguidamente se oxida los alcoholes de la misma
al compuesto dicetónico Mob 40.
Las γ-lactonas, pueden también prepararse de manera análoga,
como se muestra a continuación:

2.
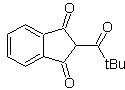
Adición del grupo COOR como grupo
activante
La adición del grupo COOR, además de activar el sintón
aniónico, facilita la desconexión de una molécula 1,4 diX.
|
Sintetizar |
|
MOb 41. Análisis retrosintético.
Leer más: Otras estrategias de síntesis que utilizan sintones "ilógicos·
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 33270
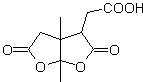
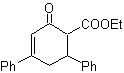
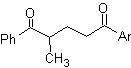
DESCONEXIONES DE COMPUESTOS 1,3-DIOXIGENADOS
Los compuestos orgánicos oxigenados,
son los más abundantes en la naturaleza y en particular los dioxigenados, razón
por la cual, muchos investigadores químicos, han modelizado la desconexión
retrosintética de estas moléculas, aspecto que se estudiará en los siguientes
párrafos.
Para empezar, los modelos de
desconexión de moléculas dioxigenadas, se han dividido en dos grandes grupos,
atendiendo a la naturaleza de los síntones que se generan con la aplicación de
una operación sintética básica
denominada “DESCONEXIÓN” a la
molécula a ser sintetizada y que generalmente se la denomina como molécula objetivo (MOb).
Estos grandes grupos son:
![]() Modelos de desconexión “lógicos”,
y
Modelos de desconexión “lógicos”,
y
![]() Modelos de desconexión “anómalos
“ o “ilógicos”
Modelos de desconexión “anómalos
“ o “ilógicos”
Los modelos de desconexión
denominados “lógicos”, son aquellos que por la aplicación de una “desconexión”
de uno o varios enlaces químicos en
Los compuestos que pueden
clasificarse como 1,3-dioxigenados y 1,5-dioxigenados, cuando son sometidos a
una retrosíntesis, generalmente forman sintones considerados “lógico”. En
cambio, las moléculas orgánicas con relación 1,2-dioxigenadas, 1.4-dioxigenadas
y 1,6-dioxigenadas, generan sintones
considerados “ilógicos”
Modelo de desconexión
1,3-dioxigenado
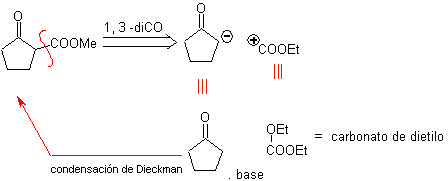
![]() Compuestos β-dicarbonílicos
Compuestos β-dicarbonílicos
Los compuestos 1,3-dicarbonílicos
se obtienen con buenos rendimientos a través de reacciones de condensación del
tipo Claisen, que implican la reacción entre ésteres y compuestos con
hidrógenos activos, tales como: ésteres, cetonas, aldehídos, nitrilos,
nitroderivados y algunos hidrocarburos en presencia de reactivos alcalinos.
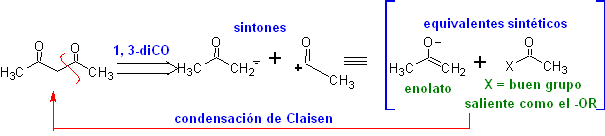
Las β-dicetonas y los β-cetoaldehidos se obtienen por la
condensación de Claisen cruzada, utilizando una cetona y un éster adecuados. En
la condensación de Claisen cruzada de cetonas y ésteres se obtienen buenos
rendimientos debido a que las cetonas son notablemente más ácidas que los
ésteres, por lo tanto, en el medio básico la cetona se desprotona en mayor
grado que el éster
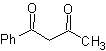
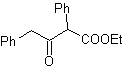
Ejemplos: Proponer un diseño de síntesis a
partir de materiales simples, para las siguientes moléculas:
|
MOb 16
|
|
MOb 17
|
|
MOb 18
|
Solución:
MOb 16. Aparentemente las dos alternativas
de desconexión (a) y (b), mostradas en
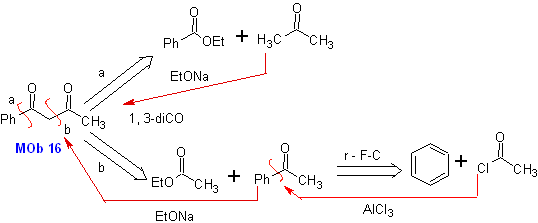
Sin embargo, la alternativa (b), resulta ser la más adecuada,
en razón a que, en el medio básico de la reacción, el carbanión formado PhCOCH2-
estaría mejor estabilizado, por efectos de resonancia e inductivos.
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 65927
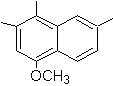
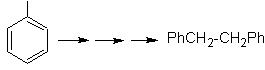
SÍNTESIS DE COMPUESTOS AROMÁTICOS I
(Método del Árbol de Síntesis)
Proponer un plan de síntesis, a
partir del tolueno o xileno como materiales de partida, para las siguientes
moléculas:
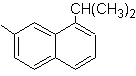
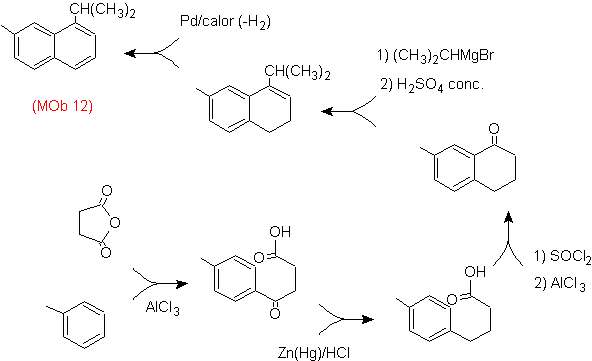
|
(MOb 12)
1-isopropil-7-metilnaftaleno |
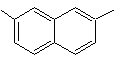
(MOb 13)
2,7-dimetilnaftaleno |
|
|
|
|
(MOb 14)
1-isopropil-6-metilnaftalen
|
(MOb 15)
4-metox-1,2,7-trimetilnaftaleno |
Solución:
(MOb 12).
En la estrategia que se asume, se
toma en cuenta que la última etapa puede responder a un proceso de
“aromatizacion”, por lo cual se propone que la molécula precursora presenta un
anillo no aromático, con un doble enlace
sobre el carbono que contiene el doble enlace y el grupo alquilico.
Esta
estructura se puede conseguir por la acción del un Grignard sobre un carbonilo
y la posterior deshidratación del alcohol formado. La cetona se forma por la
acilación sobre el compuesto bencénico adecuado con el anhídrido succínico y
sus posteriores cierres intramoleculares de acilación de Friedel -Crafts.
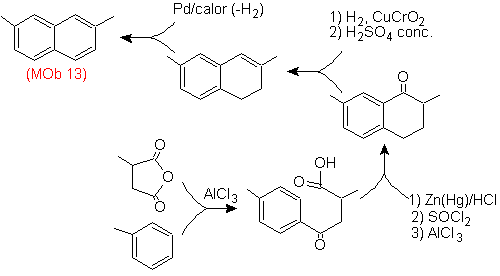
Solución (MOb
13).
Nuevamente la molécula precursora
tiene que se “aromatizada”, la estrategia mas adecuada de entre otras se basa en la combinación de acilación con
anhídrido succínico sustituido y la reducción de Clemmensen.
El
carbonilo final se reduce a alcohol que será deshidratado luego con hidrogeno
molecular y un catalizador denominado cromilo de cobre.
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 30648
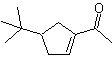
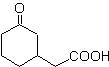
Los compuestos 1,5-dioxigenados generalmente son resultado de
reacciones de adición conjugada de nucleófilos provenientes de compuestos
carbonílicos, con Hα acídicos (enoles,
enolatos, enaminas, etc.), al igual que nitrilos y nitratos, sobre sustratos
alfa beta insaturado respecto a grupos carbonílicos y similares, conocida como
reacción de Michael, siendo opciones complementarias, la reacción de Nef y la
reacción de anelación (anillación) de Robinson.
Modelo de desconexión 1, 5 dioxigenado
(1,5-diO)
El modelo de desconexión 1,5-diO, puede ser aplicado, luego
de la funcionalización necesaria, a compuestos como: 1,5-dihidroxilos,
1,5-hidroxialdehidos, 1,5-hidroxicetonas, 1,5-hidroxiésteres,
1,5-cetoaldehidos, 1,5-dicetonas, 1,5-cetoésteres, 1,5-dialdehidos, etc.
Las posibilidades se incrementan, si además se toma en cuenta
a los nitroderivados y nitrilos, que pueden formar en medio básico, carbaniones
muy reactivos capaces de adicionarse a compuestos a,b-insaturado carbonílicos,
para obtener productos del tipo 1,5-diO.
El análisis fundamental de la desconexión
de los compuestos 1,5-diO es el siguiente:
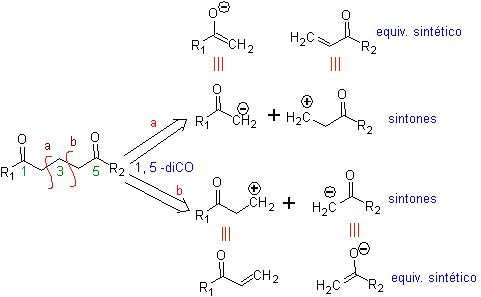
La elección de la desconexión (a) o (b), en torno al C3,
dependerá de la naturaleza de los grupos R1 y R2, que puedan conferir una mayor
o menor estabilidad al sintón o equivalente sintético necesarios para la
formación de
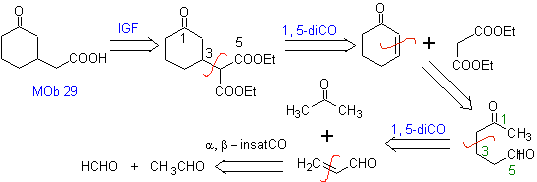
Proponer un diseño de síntesis para las MOb 29, 30 y
|
MOb 29
|
|
MOb 30
|
|
MOb 31
|
Solucion:
MOb 29. Análisis retrosintético:
El carbanión necesario para adicionarse al compuesto a,b-
insaturado CO puede obtenerse a partir
del malonato de dietilo en medio básico. Que posteriormente obligará a una
descarboxilación, para llegar a
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 34724
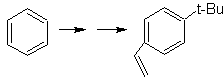
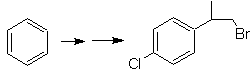
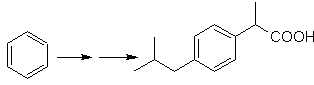
SINTESIS DE COMPUESTOS AROMÁTICOS
II
(Método del Árbol de
Síntesis)
Si bien uno de los primeros
problemas a resolver en la síntesis de los compuestos aromáticos multi-
sustituidos, es el control de los efectos orientadores y la formación de
isómeros no deseados, es también importante estudiar la reactividad de los
arenos, en tanto que en algún sentido la presencia de grupos alifáticos en el
compuesto aromático, muchas veces, presentan características y reactividades,
propias del tipo de compuesto orgánico al que pertenecen y las particulares
que resultan de la interacción mutua de los grupos alifáticos y aromáticos.
En ese propósito, se basa,
la síntesis de las moléculas Nº 20 al
27, esta vez a partir de materiales
especificados, por lo que la interrogante, se presenta del siguiente modo: ¿Cuáles
son las reacciones que justifican las
siguientes transformaciones?:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
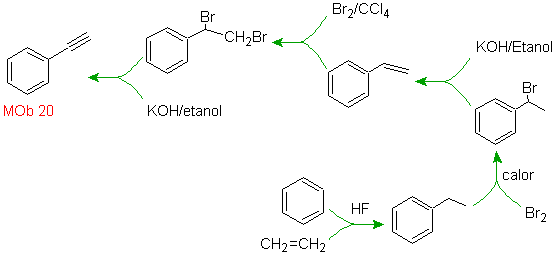
Solución MOb
20.
Sabemos que no existe la
posibilidad de que el ión acetiluro actúe directamente sobre el benceno, por
consiguiente el triple enlace se obtiene
a partir de un grupo alquílico
vec-dibromado, que se obtiene por bromación del estireno, obtenido
previamente por una deshidrobromacion de
un haluro de bencilo formado por una bromación por el mecanismo de radicales
libres sobre el etilbenceno
Solución MOb
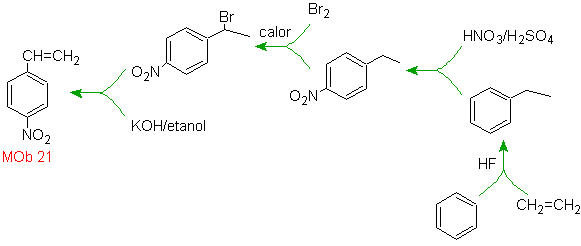
21.
El para nitroestireno, no es
posible obtener por nitración directa del estireno, debido a que el grupo
etenilo unido al anillo es inestable en las condiciones de la nitración.
En tal virtud la molécula
precursora tendrá un grupo que sea fácil de deshidrobromar. Este precursor se
obtiene por Bromación de radicales del grupo etilo ligado al anillo bencénico,
que previamente fue nitrado mayoritariamente en la posición para.
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 76733
En el diseño de síntesis de una molécula con varios grupos funcionales, es muy común que un reactivo que produce una transformación sobre un grupo funcional, afecte también a otro grupo presente en otra parte de la molécula. En los casos en que no se puede lograr una quimioselectividad adecuada sobre el grupo funcional que tiene que transformarse, el grupo que debe permanecer inalterado se protege convirtiéndolo temporalmente en una funcionalidad inerte a las condiciones de la reacción.
La operación de protección, requiere del siguiente procedimiento:
· Proteger el grupo o los grupos funcionales más reactivos selectivamente y en condiciones suaves.
· Efectuar la reacción sobre el grupo funcional requerido sin afectar el grupo protegido
· Desproteger el grupo funcional, sometido a protección
La acción de protección debe satisfacer los siguientes requisitos básicos:
· La reacción debe tener buen rendimiento y ser quimioselectiva
· El nuevo grupo funcional debe ser estable en las condiciones de la reacción del grupo que reaccionará
· La funcionalidad introducida no debe agregar centros quirales a la molécula que puedan generar diasterómeros
· El grupo funcional original debe poder regenerarse con buen rendimiento y sin afectar al resto de la molécula
El uso de protectores debe reducirse al mínimo indispensable y su elección debe ser tal que no se requiera reemplazarlos a lo largo de la síntesis ya que los pasos de introducción y remoción (desprotección) suman costo y trabajo a la síntesis y disminuyen el rendimiento. Ejemplo.
Se ha protegido el grupo cetónico de la molécula transformándolo en un cetal cíclico, con un etanodiol en medio ligeramente ácido, posteriormente se ha hecho reaccionar esta molécula con dos moles del bromuro de fenil magnesio, que actúa sobre el grupo éster, para transformarlo en un alcohol terciario, con dos sustituyentes metilo aportados por el Grignard. Finalmente se hidroliza el cetal cíclico para regenerar la cetona.
No existe en la práctica un grupo protector perfecto para cada funcionalidad, en cambio se puede afirmar de que existe una gran batería de protectores posibles, cada uno de los cuales cumple las condiciones anteriores en determinadas circunstancias. Una lista breve, de protección de los grupos más comunes, se recoge en los siguientes apartados:
Leer más: Protección de Grupos Funcionales en Síntesis Orgánica
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 37968
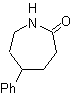
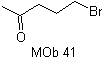
SÍNTESIS
DE ALCOHOLES
(Método del
Árbol de Síntesis)
Proponer un plan de síntesis, para
las moléculas objetivo señaladas a partir de moléculas simples que se indican
(MOb 30 -41). Para ello, utilice los reactivos y condiciones de reacción que
crea necesarios:
Solución
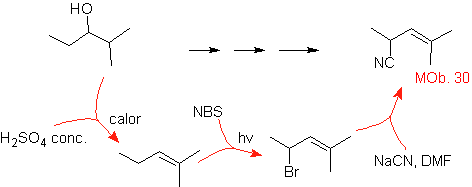
MOb 30.
Estrategia:
Se observa que la molécula de partida ha sido deshidratada y en la posición
alílica inicialmente no sustituida, se ha desplazado un hidrógeno por el grupo
ciano o nitrilo. Esta última reacción puede ocurrir sólo si la molécula
precursora es un haluro alílico, razón por la cual se propone a la misma como
precursora de
El Br se introduce en la posición
deseada con el NBS y el alqueno es producto de la deshidratación de la molécula
de partida.
Solución
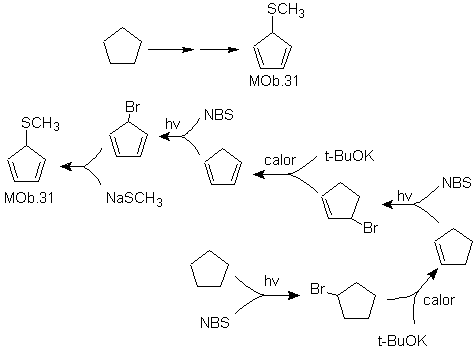
MOb 31.
Estrategia:
Se trata de un tío éter, la molécula precursora necesaria será un haluro del
1,3-ciclopentadieno.
Este haluro se prepara por la acción del NBS, sobre
el cicloalqueno dienico, el cual a su vez es preparado por la deshidrobromación
de la molécula precursora, al que se llega por la acción del NBS sobre el
cicloalqueno formado previamente por
deshidrohalogenación de la molécula de partida bromada por radicales
Solución
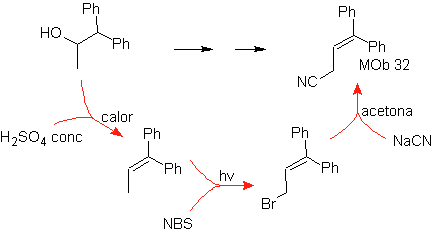
MOb 32.
Estrategia:
Es similar a la utilizada en la obtención de
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 33454
El control en síntesis orgánica, es una de las labores más importantes, para conseguir la transformación requerida o planificada y/o de evitar la formación de aquellos subproductos que perjudican sustancialmente el desarrollo óptimo de la síntesis orgánica encarada. Asimismo desde una perspectiva más general, el control también puede comprender o abarcar a los aspectos de simetría y selectividad.
Entonces, por control se deberá entender a una serie de operaciones sintéticas, que permiten al químico, formar el esqueleto carbonado con la funcionalidad pretendida o de “colocar” un grupo o átomo en el lugar o posición requeridos.
Consiguientemente, estas operaciones podrán ser de una variada gama de rutinas con una intencionalidad reflexionada por el químico y que demandan de éste, ciertas habilidades cognitivas y destrezas similares a las artísticas, para la construcción (síntesis) de las moléculas orgánicas.
En tal virtud, en las reacciones de condensación, como en otras, las operaciones de control, pueden estar comprendidas, en alguna de las siguientes categorías.
![]() Reacciones competitivas (autocondensación y/o condensación cruzada)
Reacciones competitivas (autocondensación y/o condensación cruzada)
![]() Activación – desactivación
Activación – desactivación
![]() Selectividad y especificidad
Selectividad y especificidad
![]() Protección- desprotección
Protección- desprotección
En las reacciones de condensación de compuestos carbonílicos, es fundamental establecer anticipadamente el orden de los eventos para minimizar o en su caso suprimir las posibilidades de autocondensación y la ocurrencia de condensaciones cruzadas, que lamentablemente son una evidente amenaza en estas reacciones..
Autocondensación
Todo compuesto carbonílico que posee uno o más hidrógenos alfa, en los carbonos adyacentes al grupo carbonilo, corren el riesgo de sufrir una reacción de autocondensación si no se procede con el rigor correspondiente.
Así por ejemplo, si a una 2-butanona, se agrega una base no hidroxilada como el EtONa, se formará un enolato que podría eventualmente combinarse con otra molécula de la misma cetona. De igual modo, si se agrega H+, puede también ocurrir un autocondensación, como puede verse en el siguiente esquema: Esto puede minimizarse agregando con la misma velocidad, desde alimentadores separados, la base o ácido al compuesto que proporcionará el enol o enolato y el compuesto carbonílico que será atacado en el carbono carbonílico. Un balón de tres cuellos y agitación magnética puede servir.
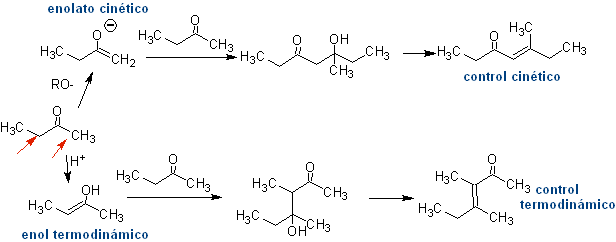
Leer más: Control en las condensaciones de compuestos carbonílicos
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 29703
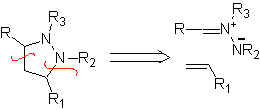
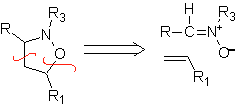
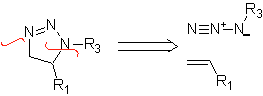
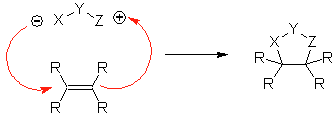
Estas reacciones normalmente forman anillos heterocíclicos de cinco eslabones, para lo cual es necesario la reacción entre un compueston1,3 dipolar y un alqueno. La reacción es una cicloadición [3-2]. Los compuestos 1,3-dipolares que más uso han tenido para formar heterociclos pentagonales son:
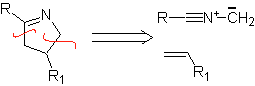 |
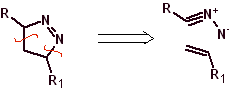 |
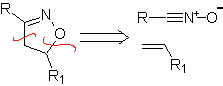 |
 |
 |
 |
| MOb: 86
|
. |
MOb: 87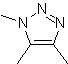 |
.. |
MOb: 88 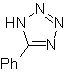 |
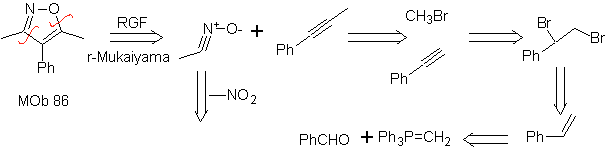
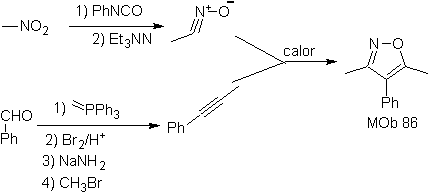
Leer más: Síntesis de heterociclos por ciclación intermolecular