¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
TEORÍA DE ALDEHÍDOS Y CETONAS
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 322702
Los aldehídos se nombran reemplazando la terminación -o del alcano correspondiente por -al. No es necesario especificar la posición del grupo aldehído, puesto que ocupa el extremo de la cadena (localizador 1).
Cuando la cadena contiene dos funciones aldehído se emplea el sufijo -dial.
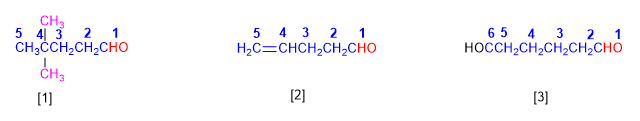
[1 ] 4,4-Dimetilpentanal
[2 ] Pent-4-enal
[3 ] Hexanodial
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 182234
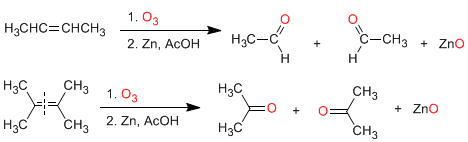
Los aldehídos y cetonas pueden ser preparados por oxidación de alcoholes, ozonólisis de alquenos, hidratación de alquinos y acilación de Friedel-Crafts como métodos de mayor importancia.
a) Ozonólisis de alquenos: Los alquenos rompen con ozono formando aldehídos y/o cetonas. Si el alqueno tiene hidrógenos vinílicos da aldehídos. Si tiene dos cadenas carbonadas forma cetonas.
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 78853
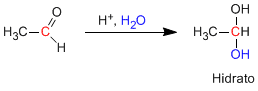
Los aldehídos y cetonas reaccionan en medio ácido acuoso para formar hidratos. El mecanismo consta de tres etapas. La primera y más rápìda consiste en la protonación del oxígeno carbonílico. Esta protonación produce un aumento de la polaridad sobre el carbono y favorece el ataque del nucleófilo. En la segunda etapa el agua ataca al carbono carbonilo, es la etapa lenta del mecanismo. En la tercera etapa se produce la desprotonación del oxígeno formándose el hidrato final.
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 108101
Los hemiacetales se forman por reacción de un equivalente de alcohol con el grupo carbonilo de un aldehído o cetona. Esta reacción se cataliza con ácido y es equivalente a la formación de hidratos.
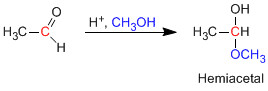
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 105820
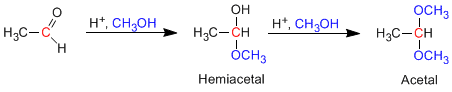
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 71728
Los 1,2- y 1,3-dioles reaccionan con aldehídos y cetonas formando acetales cíclicos. Los equilibrios se desplazan hacia el producto final eliminando el agua formada por destilación azeotrópica con benceno o tolueno.
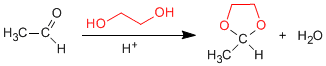
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 63532
 Los acetales pueden emplearse, por su estabilidad, como grupos protectores del carbonilo. El acetal es un éter, muy estable en medios básicos, aunque rompe en presencia de medios ácidos. En muchos procesos de síntesis el grupo carbonilo es incompatible con el reactivo utilizado. En estos casos debe protegerse para evitar que reaccione. La inestabilidad del acetal en medio ácido puede emplearse para desproteger el carbonilo.
Los acetales pueden emplearse, por su estabilidad, como grupos protectores del carbonilo. El acetal es un éter, muy estable en medios básicos, aunque rompe en presencia de medios ácidos. En muchos procesos de síntesis el grupo carbonilo es incompatible con el reactivo utilizado. En estos casos debe protegerse para evitar que reaccione. La inestabilidad del acetal en medio ácido puede emplearse para desproteger el carbonilo.
Veamos algunos ejemplos:
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 110109
La reacción de aldehídos o cetonas [1] con aminas primarias genera iminas [2]. La reacción se favorece en un medio ligeramente ácido (pH=4.5).
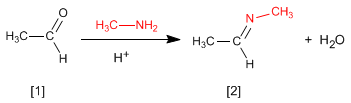
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 77853
Las oximas [3 ] se obtienen por reacción de aldehídos o cetonas [1 ] e hidroxilamina [2 ] en un medio débilmente ácido. El mecanismo es análogo al de formación de iminas.
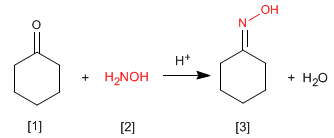
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 69720
Las hidrazonas [3 ] se obtienen por reacción de aldehídos o cetonas [1 ] con hidrazina [2 ]. Igual que en el caso de las iminas y oximas requiere pH=4.
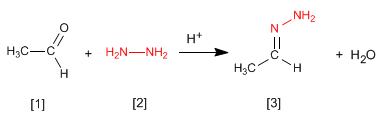
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 36119
La hidrazina [2 ] reacciona con dos moleculas de aldehido [1 ] para formar azinas [3 ].
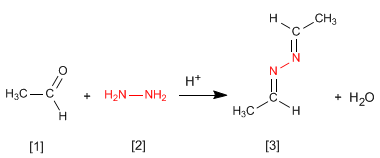
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 41773
Las semicarbazonas [3 ] se obtienen por reacción de aldehídos o cetonas [1 ] con semicarbazida [2 ]. Veamos un ejemplo:
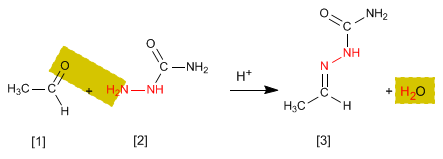
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 129815
Se trata de un ensayo analítico específico de aldehídos y cetonas. Los carbonilos [1 ] reaccionan con 2,4-Dinitrofenilhidrazina [2 ] formando fenilhidrazonas [3 ] que precipitan de color amarillo. La aparicion de precipidado es un indicador de la presencia de carbonilos en el medio.
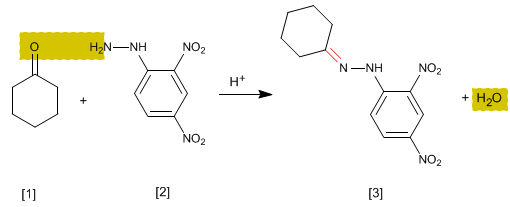
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 61174
Síntesis de enaminas
Como vimos en apartados anteriores la condensación de aminas primarias con aldehídos y cetonas generan iminas. En este apartado estudiaremos la condensación de carbonilos con aminas secundarias que dan enaminas.
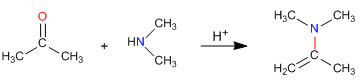
Mecanismo de formación de enaminas
Después del ataque inicial de la amina secundaria al carbonilo, se elimina agua formándose el doble enlace entre el carbono carbonilo y el alfa del carbonilo de partida.
Etapa 1. Protonación del carbonilo
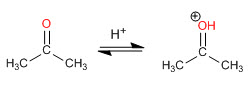
Etapa 2. Ataque nucleófilo de la amina secundaria
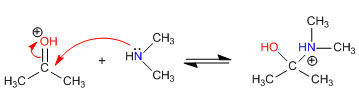
Etapa 3. Equilibrio ácido-base
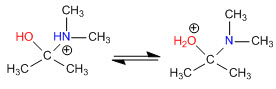
Etapa 4. Pérdida de agua
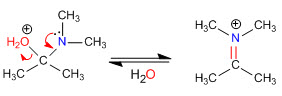
Etapa 5. Eliminación
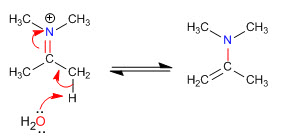
Los impedimentos estéricos hacen que las enaminas menos sustituidas sean las más estables
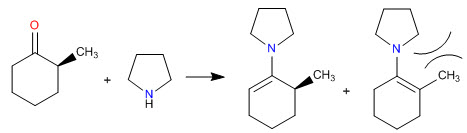
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 72781
Las cianhidrinas [3 ] se forman por reacción de aldehídos o cetonas [1 ] con ácido cianhídrico [2 ] y son compuestos que contienen un grupo cinano y un hidroxi sobre el mismo carbono.
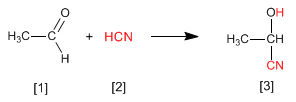
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 89417
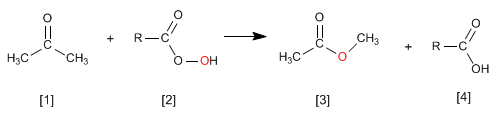
La reacción de Wittig emplea Iluros de fósforo [2 ] para transformar aldehídos y cetonas [1 ] en alquenos [3 ]. Como subproducto se obtiene el óxido de trifenilfosfina [4 ].
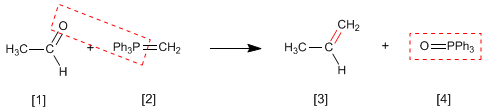
- Detalles
- Germán Fernández
- TEORÍA DE ALDEHÍDOS Y CETONAS
- Visto: 92161
La reacción de cetonas [1 ] con perácidos [2 ] produce ésteres [3 ]. El oxígeno del perácido se inserta entre el carbono carbonilo y el carbono alfa de la cetona. Esta reacción fue descrita por Adolf von Baeyer y Victor Villiger in 1899.