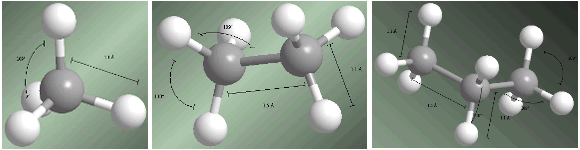
Los alcanos son compuestos con hibridación sp3 en todos sus carbonos. Los cuatro sustituyentes que parten de cada carbono se disponen hacia los vértices un tetraedro.
Las distancias y ángulos de enlace se muestran en los siguientes modelos.
Los alcanos de menor tamaño, metano, etano, propano y butano son gases a temperatura ambiente. Los alcanos lineales desde C5H12 hasta C17H36 son líquidos. Alcanos de  mayor número de carbonos son sólidos a temperatura ambiente.
mayor número de carbonos son sólidos a temperatura ambiente.
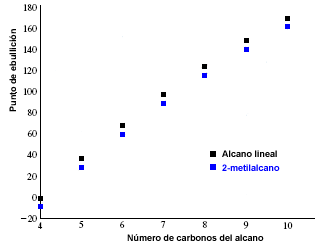
Los puntos de fusión y ebullición de los alcanos aumentan con el número de carbonos de la molécula. También se observa que los alcanos ramificados presentan un punto de ebullición menor que sus isómeros lineales.
En la siguiente gráfica se representan los puntos de ebullición de alcanos lineales (en negro) y los correspondientes a sus 2-metilalcanos isómeros (en azul).
En fase líquida existen fuerzas de atracción entre moléculas que las mantiene unidas. Para pasar a fase gas la sustancia es necesario vencer estas fuerzas intermoleculares mediante el aporte de energía.

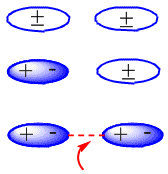
En moléculas neutras, como son los alcanos, las fuerzas atractivas son debidas a interacciones de van der Waals que pueden ser de tres tipos: interacciones dipolo – dipolo, dipolo – dipolo inducido y dipolo inducido – dipolo inducido.
La formación de los dipolos inducidos que producen la atracción entre moléculas neutras puede verse en el siguiente esquema:
Consideremos los isómeros del pentano, como ejemplo de la disminución en el punto de ebullición, al pasar de alcanos lineales a ramificados.
El pentano tiene una importante área superficial que permite gran número de interacciones dipolo inducido – dipolo inducido. El 2-Metilbutano es más compacto y posee menor área superficial, menos interacciones intermoleculares y menor punto de ebullición.









