¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
TEORÍA DEL BENCENO
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 249716
Los bencenos monosustituidos se nombran terminando el nombre del sustituyente en benceno.
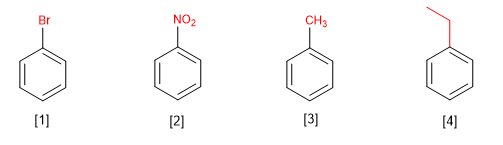
[1 ] Bromobenceno
[2 ] Nitrobenceno
[3 ] Metilbenceno (tolueno)
[4 ] Etilbenceno
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 112996
El benceno actúa como nucleófilo, atacando a un número importante y variado de electrófilos.
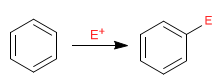
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 172981
El benceno reacciona con la mezcla nitrico-sulfurico adicionando grupos nitro.
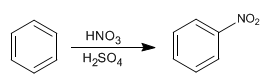
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 152802
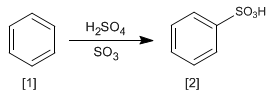
La reaccion del benceno [1 ] con una disolución de trióxido de azufre en ácido sulfúrico produce ácidos bencenosulfónicos [2 ].
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 139841
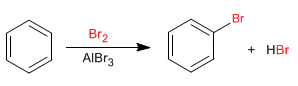
El benceno reacciona con halógenos en presencia de ácidos de Lewis para formar derivados halogenados.
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 97093
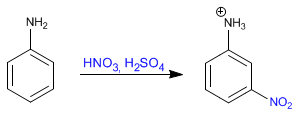
Leer más: Benceno - Protección y desprotección del grupo amino
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 13370
El grupo amino se introduce en el anillo aromático por reducción del nitro.
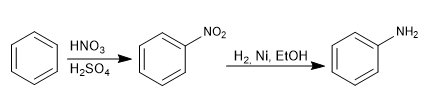
Los reactivos empleados en la reducción pueden ser:
- Sn, HCl
- H2, Ni, EtOH
- Fe, HCl
Leer más: Reducción de nitro a amino y oxidación de amino a nitro
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 9242
La reversibilidad de la sulfonación permite emplearla para proteger posiciones activadas del benceno. Veamos un ejemplo:
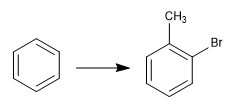
Para obtener el o-bromotolueno, realizamos los siguientes pasos:
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 11425
La reacción del 1-cloro-2,4-dinitrobenceno con nucleófilos (hidróxido, amoniaco, metóxido, etc), produce la sustitución del cloro por el nucleófilo correspondiente. Se denomina ipso (mismo lugar), para indicar que el nucleófilo ocupa la misma posición que tenía el cloro de partida.
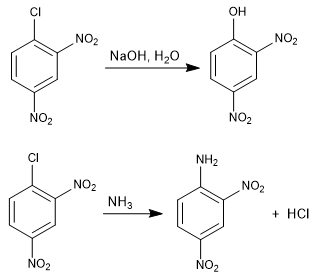
Leer más: Sustitución nucleófila aromática por adición-eliminación
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 64922
Los bencenos halogenados reaccionan con sosa diluida en condiciones de alta presión y temperatura, para formar fenoles. Esta reacción no requiere grupos desactivantes en posición orto/para y sigue un mecanismo diferente al de la sustitución nucleófila aromática por adición-eliminación.
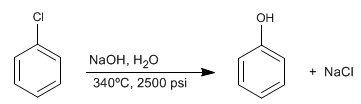
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 11057
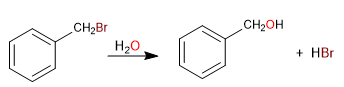
El carbono unido directamente al benceno se conoce como posición bencílica. En esta posición se forman carbocationes, carbaniones y radicales de gran estabilidad por la posibilidad de deslocalizar la carga en el anillo aromático.
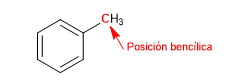
SN1 en posiciones bencílicas
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 12058
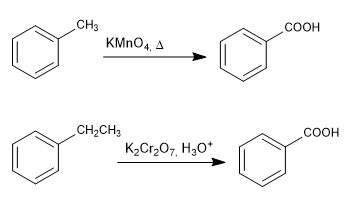
Oxidación de cadenas con permanganato y dicromato
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 9295
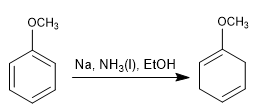
La reducción de Birch emplea como reactivos sodio o litio en disolución, su mecanismo es radicalario y reduce el benceno a un 1,4-ciclohexadieno.
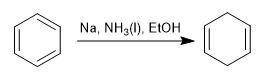
Birch con sustituyentes activantes
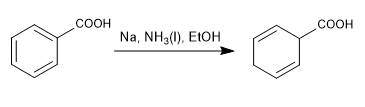
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 8880
Los alil fenil éteres sufren al calentarlos una reacción concertada, que supone el movimiento de seis electrones, llamada transposición de Claisen. El intermedio formado en la reacción es de alta energía y se tautomeriza rápidamente para dar el producto final
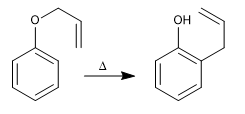
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 11717
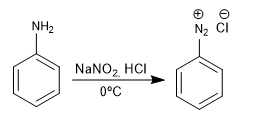
Las sales de bencenodiazonio son atacadas por nucleófilos en presencia de sales de cobre (I) que actúan de catalizador, obteniéndose una gran variedad de productos.
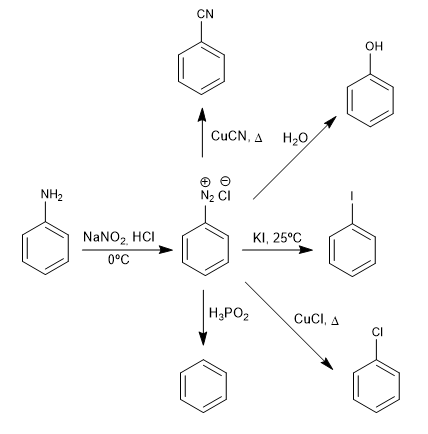
- Detalles
- Germán Fernández
- TEORÍA DEL BENCENO
- Visto: 10316
Formación de azocompuestos