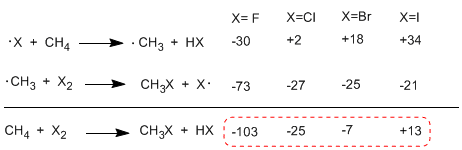¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
TEORÍA REACCIONES DE HALOGENACIÓN
- Detalles
- Germán Fernández
- TEORÍA REACCIONES DE HALOGENACIÓN
- Visto: 4901
Los alcanos reaccionan con halógenos mediante mecanismos radicalarios. Dicha reacción supone la sustitución de uno o varios hidrógenos del alcano por halógenos.
Mecanismo de la halogenación radicalaria
El mecanismo de la halogenación radicalaria consta de tres etapas: iniciación, propagación y terminación. En la iniciación la molécula de halógeno rompe de forma homolítica generando radicales. En la etapa de propagación se produce la sustitución de hidrógenos del alcano por halógenos. Cuando los reactivos se agotan, los radicales que hay en el medio se unen entre si, produciéndose la etapa de teminación.
Reactividad de los halógenos
La primera etapa de propagación determina la velocidad de la reacción. Para el flúor esta etapa es de baja energía de activación lo que convierte al flúor en el halógeno mas reactivo. En el caso del yodo la energía de activación es muy elevada y la reacción no se produce. Orden de reactividad en reacciones radicalarias : $F_2>Cl_2>Br_2>I_2$. En resumen, el yodo no es reactivo en la halogenación radicalaria y el flúor reacciona de forma violenta.
Polihalogenaciones
La reacción de halogenación es difícil de parar, puesto que el producto halogenado es más reactivo que el alcano de partida. Para evitar esté problema, llamado polihalogenaciones, se utiliza exceso del alcano.
Estabilidad de radicales
El mecanismo de estas reacciones transcurre con formación de un intermedio llamado radical cuya estabilidad depende del número de sustituyentes que rodean el carbono que contiene el electrón solitario. Los radicales formados en la etapa de propagación se estabilizan por hiperconjugación. El orden de estabilidad de los radicales viene dado por: terciarios > secundarios > primarios.
- Detalles
- Germán Fernández
- TEORÍA REACCIONES DE HALOGENACIÓN
- Visto: 65482
MECANISMO DE LA REACCIÓN
Las halogenaciones radicalarias trancurren en tres etapas denominadas: iniciación, propagación y terminación:
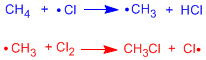
Etapa de iniciación
En el primer paso de la reacción se produce la rotura homolítica del enlace Cl-Cl. Esto se consigue con calor o mediante la absorción de luz.
![]()
- Detalles
- Germán Fernández
- TEORÍA REACCIONES DE HALOGENACIÓN
- Visto: 33747
Vamos a representar en un diagrama de energía las dos etapas de propagación de la halogenación del metano.
La primera etapa de propagación es la que limita la velocidad del proceso, tiene la mayor energía de activación. En el diagrama se representan reactivos, productos, intermedios y estados de transición para la halogenación radicalaria del metano.
- Detalles
- Germán Fernández
- TEORÍA REACCIONES DE HALOGENACIÓN
- Visto: 25221
Al comparar las entalpías de las etapas de propagación de los diferentes halógenos, se observan importantes diferencias en los calores intercambiados. En el caso del flúor ambos pasos son exotérmicos (incluso la abstracción del hidrógeno) con un balance energético global de -103 Kcal/mol. Las energías de activación de los estados de transición en esta reacción son muy bajos, este hecho lo convierte en el halógeno más reactivo.
En el otro extremo de la reactividad se encuentra el yodo, cuya reacción es endotérmica y no tiene lugar.
Orden de reactividad F2>Cl2 > Br2> I2
En la siguiente tabla se muestran los calores intercambiados en las etapas de propagación para la halogenación del metano.
La reacción es fuertemente exotérmica en el caso del flúor (halógeno más reactivo) mientras que en el caso del yodo es endotérmica en 13 Kcal/mol.
- Detalles
- Germán Fernández
- TEORÍA REACCIONES DE HALOGENACIÓN
- Visto: 26444
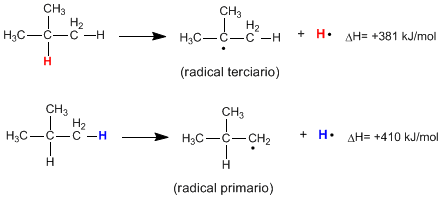
Al romper de forma homolítica el enlace C-H de un alcano se producen radicales alquilo y átomos de hidrógeno libres. La energía necesaria para que ocurra esta rotura se denomina energía de disocíación y es tanto menor cuanto más estable sea el radical formado.
Como puede verse en las siguientes reacciones, la energía necesaria para romper un enlace C-H primario es muy superior a la requerida para romper el enlace C-H terciario.
Leer más: Estabilidad de radicales en halogenaciones radicalarias
- Detalles
- Germán Fernández
- TEORÍA REACCIONES DE HALOGENACIÓN
- Visto: 33750
En el propano existen dos tipos de hidrógenos no equivalentes que pueden ser sustituidos por el halógeno, obteniéndose 1-cloropropano y 2-cloropropano.
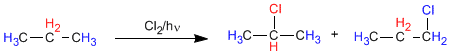
La proporción en que se obtienen estos productos depende de dos factores: número de hidrógenos que hay para sustituir por halógeno y estabilidad del radical formado.
- Detalles
- Germán Fernández
- TEORÍA REACCIONES DE HALOGENACIÓN
- Visto: 7743
Usa el editor para dibujar el producto de la primera reacción y pulsa en el botón "Respuesta". En la pantalla de información te dirá si es correcto y los puntos que vas acumulando o perdiendo. Borra la molécula con el botón que tiene una pantalla blanca y selecciona el siguiente producto de reacción.
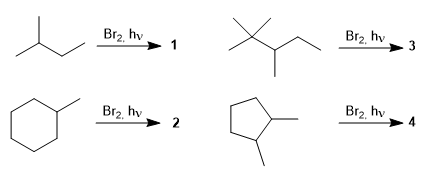
[*] El producto 4 es de monohalogenación.
Leer más: Autoevaluación | Escribir productos de halogenación radicalaria